Сосудистые заболевания нервной системы
В разделе опубликованы материалы об обследовании и лечении пациентов с сосудистыми заболеваниями головного и спинного мозга. Также освещены вопросы первичной и вторичной профилактики сосудистых заболеваний. 
По данным эпидемиологических исследований установлена связь уровня холестерина и риска сердечно-сосудистых заболеваний. Нарушения липидного обмена сами по себе, а также в сочетании с другими факторами риска развития заболеваний ССС могут приводить к развитию атеросклероза, и повышают риск сердечно-сосудистых и цереброваскулярных заболеваний.
К дислипидемиям относится широкий спектр нарушений, часть из которых играет важную роль в развитии сердечно-сосудистых заболеваний.
Оценка показателей липидного обмена после достижения возраста 40 лет - показана мужчинам, а в возрасте 50 лет - вне зависимости от пола; пациентам с выявленными сердечно-сосудистыми заболеваниями, а также, состояниями, которые сочетаются с повышенным риском их развития:
- хронические аутоиммунные заболевания: ревматоидный артрит, системная красная волчанка и псориаз;
- гипертония при беременности у женщин;
- эректильная дисфункция у мужчин;
- хроническая болезнь почек;
- сахарный диабет 1 и 2 типа;
- семейный анамнез раннего развития ИБС;
- лечение ВИЧ;
Развитие дислипидемий может быть обусловлено другими заболеваниями (вторичные дислипидемии) или сочетанием наследственной предрасположенности и неблагоприятных факторов окружающей среды (погрешности в диете и малоподвижный образ жизни). Наибольшее внимание уделяется повышению уровня общего холестерина (ОХ) и холестерина липопротеидов низкой плотности ХС-ЛПНП.
Липостатическая (направленная на снижение уровня холестерина и его производных) терапия рассматривается как долговременная стратегия первичной и вторичной профилактики сердечно-сосудистых заболеваний и их осложнений (смерть, инсульт, инфаркт). Лекарственная терапия и изменения образа жизни могут повлиять на величину показателей липидного спектра. При этом эффект немедикаментозных профилактических мер считается недостаточным [2].
Статины оказывают наиболее выраженное действие на липидный спектр. Другие стратегии коррекции дислипидемии (приём фибратов, секвестрантов желчных кислот, диета) не снижают сердечно-сосудистого риска. Их использование показано только при непереносимости статинов [5,12].
Использование статинов достоверно снижает смертность от сердечно-сосудистых заболеваний. Длительный опыт использования подтверждает хорошую переносимость и высокую безопасность этого класса препаратов.
Таблица 1 Эффекты различных липостатических препаратов на показатели холестеринового обмена
| Класс лекарственных препаратов | ХС-ЛПНП | ХС-ЛПВП | Триглицериды |
|---|---|---|---|
| Секвестранты желчных кислот | ↓ 15 - 30 % | 0 — лёгкое повышение | Без изменений1 |
| Никотиновая кислота | ↓ 10 - 25 % | ↑ 15 - 35 % | ↓ 25 - 30 % |
| Ингибиторы ГМГ КоА редуктазы | ↓ 20 - 60 % | ↑ 5 - 10 % | ↓ 10 - 33 % |
| Гемфиброзил | ↓ 10 - 15 % | ↑ 5 - 20 %2 | ↓ 35 - 50 % |
| Фенофибрат (микроионизированная форма) | ↓ 6 - 20 % | ↑ 5 - 20 % | ↓ 41 - 53 % |
| Ингибиторы всасывания холестерина | ↓ 17 % | ↑ 1 % | ↓ 7 - 8 % |
| Неомицин | ↓ 20 - 25 % | Без изменений | Без изменений |
| Омега-3-ненасыщенные жирные кислоты | ↑ 4 - 49 % | ↑ 5 - 9 % | ↓ 23 - 45 % |
Широкое использование препаратов этой группы для первичной и вторичной профилактики отражается в рекомендациях современных руководств. Статины как в США, так и в Европе входят в число наиболее продаваемых препаратов.
Коррекция дислипидемии при помощи статинов преследует цель — снижение общего сердечно-сосудистого риска конкретного пациента. В связи с этим, как в американском, так и в европейском соответствующих руководствах обозначается дифференцированный подход к определению дозы препаратов и целевых значений показателей липидного спектра.
Схема 1 Определение дозы статинов в зависимости от набора факторов риска сердечно-сосудистых осложнений (АКК/ААС, 2013).

Высокая доза статинов обеспечивает снижение уровня ЛПНП ≥50%
Схема 2 Шкала SCORE
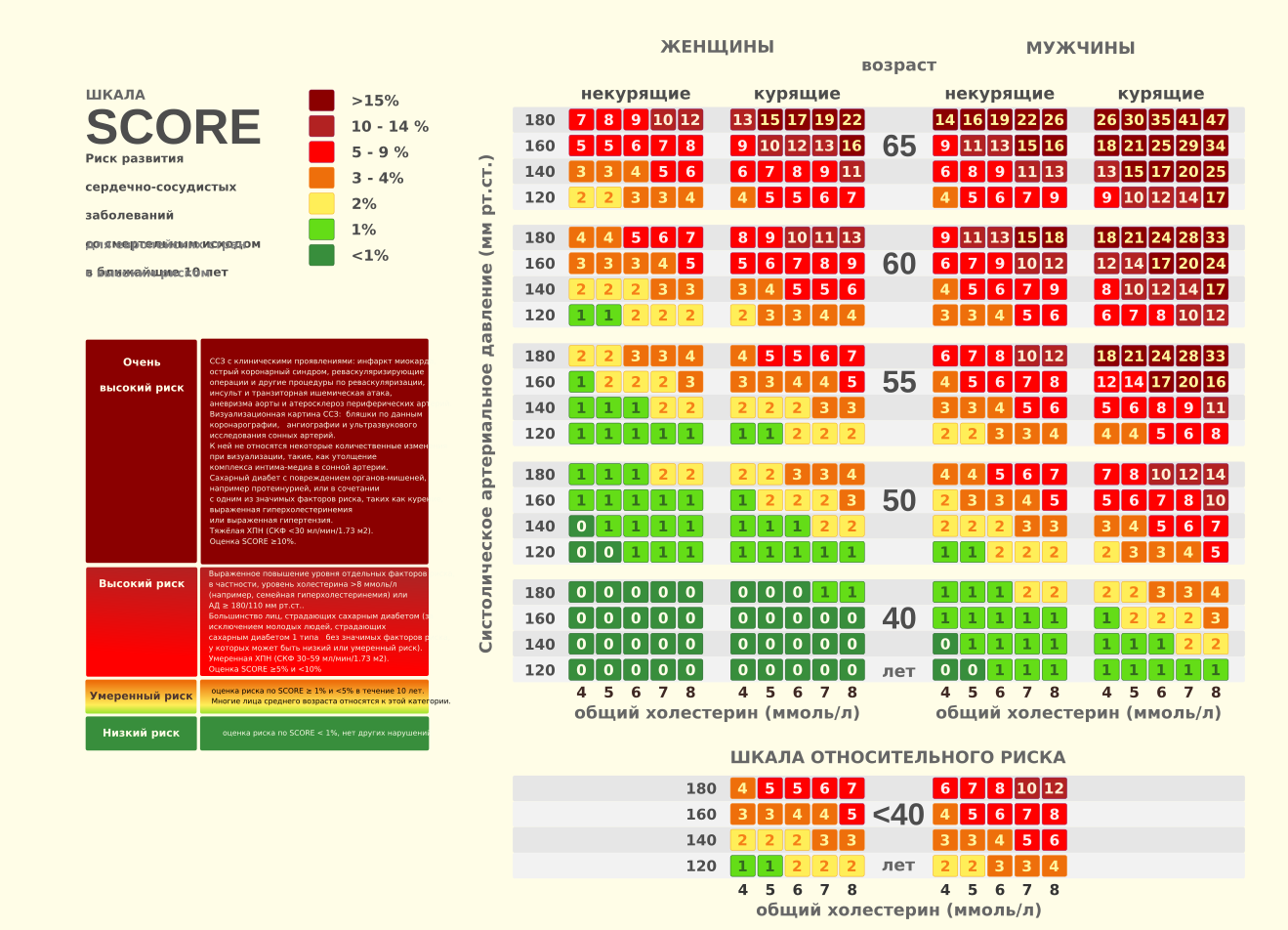
Таблица 2 Различные стратегии вмешательства в зависимости от общего риска развития сердечно-сосудистой патологии и уровня холестерина ЛПНП*
| Уровень холестерина ЛПНП (ммоль/л) | |||||
|---|---|---|---|---|---|
| Общий риск развития ССЗ (SCORE), % | <1,8 |
1,8 до <2,6 |
2,6 до <4,0 |
1,8 до <4,6 |
≥4,9 |
| <1 | Вмешательство в липидный обмен не требуется | Вмешательство в липидный обмен не требуется | Вмешательство в липидный обмен не требуется | Вмешательство в липидный обмен не требуется | Изменение образа жизни, при необходимости - лекарственная терапия |
| Класс a/Уровень b | I/С | I/С | I/С | I/С | IIa/A |
| ≥1 до <5 | Вмешательство в липидный обмен не требуется | Вмешательство в липидный обмен не требуется | Изменение образа жизни, при необходимости - лекарственная терапия | Изменение образа жизни, при необходимости - лекарственная терапия | Изменение образа жизни, при необходимости - лекарственная терапия |
| Классa/Уровеньb | I/С | I/С | IIa/A | IIa/A | I/A |
| ≥5 до <10 или высокий риск | Вмешательство в липидный обмен не требуется | Изменение образа жизни, при необходимости - лекарственная терапия | Изменение образа жизни и немедленное начало лекарственной терапии | Изменение образа жизни и немедленное начало лекарственной терапии | Изменение образа жизни и немедленное начало лекарственной терапии |
| Класс a/Уровень b | IIa/A | IIa/A | IIa/A | I/A | I/A |
| ≥10 или очень высокий риск | Изменение образа жизни, при необходимости - лекарственная терапия | Изменение образа жизни и немедленное начало лекарственной терапии | Изменение образа жизни и немедленное начало лекарственной терапии | Изменение образа жизни и немедленное начало лекарственной терапии | Изменение образа жизни и немедленное начало лекарственной терапии |
| Класс a/Уровень b | IIa/A | IIa/A | I/A | I/A | I/A |
* Руководство EOK/EOA по диагностике и лечению дислипидемий (2016)
Таблица 3 Сходства и различия в лекарственной терапии между рекомендациями ЕОА/ЕОК по терапии дислипидемий от 2011 года и рекомендациями АКК/ААС по снижению уровня холестерина в крови для уменьшения риска сердечно-сосудистых осложнений атеросклероза от 2013 года.
| ЕОА/ЕОК, 2011 | АКК/ААС, 2013 | |
|---|---|---|
| Вторичная профилактика | Целевой уровень ХС ЛПНП<1,8 ммоль/л, или по крайней мере снижение на 50 %.Если цель не может быть достигнута при помощистатинов, следует рассмотреть комбинированную терапию. | Высокая интенсивность терапии статинами. Если 50 %-ное снижение не достигается, следует рассмотреть возможность комбинированной терапии. |
| Непереносимость статинов при вторичной профилактике | Уменьшить дозу статина, рассмотреть возможность комбинированной терапии | Терапия статинами в умеренной или низкой дозе, рассмотреть возможность комбинированной терапии |
| Первичная профилактика, ЛПНП >4,9 ммоль/л | Целевой уровень ХС-ЛПНП <2,5 ммоль/л. Если целевой уровень не достигается, максимальное снижение ХС-ЛПНП с использованием комбинации существующих препаратов в переносимых дозах. | Терапия статинами в высокой дозе, направленная на достижение как минимум 50% снижения ХС ЛПНП. Если снижение на 50% не достигается, рассмотреть возможность дополнительной терапии. |
| Первичная профилактика при сахарном диабете | Сахарный диабет в сочетании с другими факторами риска или поражением органов-мишеней:целевой уровень ХС ЛПНП ≤ 1,8 ммоль/л, или по крайней мере 50 % снижение. Неосложненный сахарныйдиабет: целевой уровень ЛПНП < 2,5 ммоль/л | Сахарный диабет с высоким риском: высокая доза статинов. Диабет с низким риском: умеренная доза статинов. |
| Первичная профилактика у пациентов с высоким риском сердечно-сосудистых осложнений | SCORE ≥ 5% риск смертельного сердечно- сосудистого заболевания: целевой уровень < 2,5ммоль/л | Суммарный риск сердечно-сосудистых событий > 7,5%: терапия статинами в умеренной или высокой дозе. Риск сердечно-сосудистого события 5-7,5%: терапия статинами в умеренной дозе. |
Состояния, при которых пациенты получают лечение, соответствующее вторичной профилактике
Ишемическая болезнь сердца
- Инфаркт миокарда
- Стенокардия
- Реваскуляризирующие операции на коронарных артериях
Цереброваскулярные заболевания
- Инсульт
- Транзиторная ишемическая атака
Заболевания периферических артерий
Множественные факторы риска с общим 10-ти летним риском развития сердечно-сосудистого заболевания >20%
Хроническая болезнь почек с СКФ <45 мл/мин на 1.73 м2
©2016 UpToDate®
Механизм действия
В настоящее время принято разделять липидные и нелипидные (плейотропные) механизмы действия статинов (Е.А. Коваль, 2007).
Основной липидный механизм действия статинов лежит в блокировании активности ключевого фермента – 3-гидрокси-3-метилглутарил-коэнзим А редуктазы (ГМГ-КоА-редуктазы), который принимает участие в синтезе ХС в печени. Поскольку ХС является основным элементом внутриклеточного метаболизма, в случае его недостатка активно экспрессируются на поверхности клеток рецепторы к основной транспортной форме ХС – апоВ, в результате чего из крови захватывается основная транспортная форма ХС – ЛПНП и ЛПОНП, триглицериды (ТГ). На уровень ТГ в крови большое влияние оказывают липофильные статины, которые блокируют синтез ЛПОНП и включение в их состав белка апоВ.
Статины способны повышать уровень ХС ЛПВП, причем независимо от степени снижения в крови концентрации ХС ЛПНП. Таким образом, статины оказывают позитивное влияние на все звенья липидного обмена при атеросклерозе.
Более того, в многочисленных клинических исследованиях было установлено, что по крайней мере у пациентов из группы высокого риска снижение уровня ОХ и Х-ЛПНП связано со статистически и клинически значимым снижением риска смерти от сердечно-сосудистой патологии. Именно поэтому уровни ОХ и Х-ЛПНП остаются основными рекомендуемыми терапевтическими мишенями в данных рекомендациях
Мета-анализ 9 крупных исследований показал тесную корреляцию между снижением при помощи статинов уровня ХС ЛПНП и уменьшением толщины комплекса интима-медиа (КИМ) в сонных артериях (снижение содержания ХС ЛПНП на каждые 10% ассоциируется с уменьшением толщины КИМ на 0,73% в год).
Механизм положительного влияния снижения уровня липидов не до конца понятен. Уменьшение выраженности атеросклеротического поражения отмечается лишь у небольшой доли пациентов, кроме того, для развития клинического эффекта липостатического действия препаратов требуется не менее шести (6-12) месяцев. В основе действия статинов могут лежать такие факторы, как стабилизация бляшки, уменьшение выраженности эндотелиальной дисфункции с уменьшением тромбогенности эпителия.
Обсуждается нейропротективный потенциал ингибиторов ГМГ-КоА-редуктазы. В экспериментальном исследовании была выявлена меньшая степень выраженности неврологических симптомов, если ИИ возникал на фоне лечения статинами.
Эффекты статинов, не связанные с основным механизмом действия [9].
При проведении мета-анализа 19 исследований, выполненных с 1998 по январь 2012 года, было выделено 48 эффектов статинов, не связанных с их основным действием.
Неврологические и психические заболевания:
При проведении мета-анализа исследований статинов было установлено, что приём препаратов этой группы уменьшает риск развития деменции, умеренных (недементных) когнитивных нарушений и болезни Альцгеймера, приблизительно на 30%. Примечательно, что в более качественно спланированных исследованиях с большими размерами выборки и длительности наблюдения, эффект статинов на риск этих состояний был не так выражен. Получены менее убедительные данные о том, что лечение статинами сочетается с уменьшением риска развития болезни Паркинсона.
Несмотря на данные отдельных исследований, увеличение риска развития периферической полиневропатии, депрессии и суицидального поведения в мета-анализе не выявлено.
Нарушения со стороны органов зрения
Не было показано повышения частоты катаракты, глаукомы и возрастной макулярной дистрофии у пациентов принимающих статины.
Тромбоэмболические осложнения (тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии и ее ветвей (ТЭЛА))
Приём статинов сочетается со снижением риска тромбоэмболических осложнений, данные более качественных исследований указывают на менее выраженное влияние статинов на частоту этих состояний.
Миопатия
Было показано повышение частоты развитие миопатии при приёме статинов в 2,5-3 раза, по данным различных исследований частота осложнения составляла 2,3-9,6 на 10 000. Был показано, что наличие сахарного диабета у пациентов не оказывает влияния на риск развития миопатии.
Поражения печени и повышение активности печёночных ферментов
Было показано повышение частоты развития заболеваний печени в 1,5 раза во время первого года назначения статинов, в дальнейшем, различия были минимальными или не отмечались вовсе.
По данным двух крупных проспективных исследований частота случаев поражения печени составляло 44 и 120 на 10 000 участников, что соответствовало повышению риска на 16 и 50 случаев на 10 000 участников, соответственно.
Поражения почек
При проведении мета-анализа не было показано увеличения риска поражения почек при приёме статинов. Данные отдельных исследований противоречивы: есть работы указывающие, как на большую, так и на меньшую частоту этого вида патологии у пациентов, принимающих статины.
Сахарный диабет 2 типа
Показано незначительное увеличение риска развития сахарного диабета 2 типа (в 1.3 раза). В отдельных исследованиях, включённых в мета-анализ не было показано отрицательного влияния статинов.
Ревматоидный артрит и остеоартроз
Не было показано повышения риска развития ревматоидного артрита и остеоартроза у пациентов, принимающих статины.
Пневмония
Не было показано влияние статинов на риск развития инфекций верхних дыхательных путей.
Статины при сердечно-сосудистых заболеваниях
WOSCOP (West of Scotland Coronary Prevention Study). Западно-Шотландское исследование было первым рандомизированным плацебо-контролируемым исследованием по первичной профилактике ИБС у мужчин среднего возраста с высоким риском коронарного атеросклероза и с ГХС (ХС ЛПНП ≥5 ммоль/л). Правастатин в дозе 40 мг/сут сравнивали с плацебо. Исследование длилось 5 лет и включало 6595 человек. В процессе исследования в группе, принимавшей правастатин, уровень ХС ЛПНП был снижен на 26%, на 31% снизилась частота смертельных исходов и нефатальных ИМ, на 37% – необходимость в аортокоронарном шунтировании, смертность от всех причин снизилась на 22%. При длительном наблюдении за участниками исследования было показано, что эффект от лечения сохранялся через 5 и 10 лет, несмотря на то, что после окончания исследования, лечение участников основной и контрольной групп не отличалось [1].
По данным исследования Air Force/Texas Coronary Atherosclerosis Prevention Study (AFCAPS/TexCAPS), было показано, что ловастатин снижает вероятность первого коронарного приступа (нестабильная стенокардия, инфаркт миокарда с летальным исходом и без летального исхода, внезапная сердечная смерть) у пациентов обоего пола с низким риском, без клинических признаков сердечно-сосудистых заболеваний и близким к средним уровням ЛПНП 3.9 (3.4 — 4.9) ммоль/л. На каждую 1000 пациентов, получавших лечение ловастатином в течение 5 лет, было предотвращено 12 инфарктов миокарда и 17 реваскуляризирующих операций на коронарных артериях. Препарат не оказывал эффекта на общую смертность.
Сходные результаты были получены в исследовании ASCOT-LLA, в котором изучалось действие симвастатина (10 мг) в группе мужчин и женщин с относительно нормальным уровнем сывороточного холестерина, у которых были выявлены артериальная гипертензия и, как минимум три, дополнительных фактора риска ССЗ.
В исследовании JUPITER изучалось использование розувастатина в дозе 20 мг в сутки у здоровых молодых пациентов обоего пола с повышенным уровнем C-реактивного белка и уровнем ЛПНП ниже 3.4 ммоль/лпоказано выраженное уменьшение первичных конечных точек: cердечно-сосудистых осложнений (острый инфаркт миокарда, нестабильная стенокардия, внезапная сердечная смерть) и смерти от всех причин (отношение рисков 0.56 и 0.80, соответственно).
Статины при цереброваскулярных заболеваниях
Назначение статинов показано как при острых, так и при хронических цереброваскулярных заболеваниях.
В последнем случае, при отсутствии убедительных данных о возможности медикаментозной коррекции основных симптомов: когнитивные нарушения, нарушения ходьбы, нарушения мочеиспускания, основное значение приобретает агрессивная коррекция факторов риска сердечно-сосудистых осложнений. Эти мероприятия необходимы, но недостаточны для замедления прогрессирования микроангиопатии. В отдельных случаях, хроническое сосудистое поражение головного мозга развивается у пожилых пациентов с низким суммарным риском, что указывает на сложный патогенез состояния.
Основные данные о роли статинов во вторичной профилактике инсульта были получены в исследовании SPARCL.
В большинстве, но не во всех эпидемиологических исследованиях было показано сочетание высокой концентрации холестерина и высокого риска инсульта. Также была показана связь между высокой концентрацией холестерина и атеросклерозом сонных артерий [14].
Данные о влиянии уровня холестерина на риск развития геморрагического инсульта противоречивы. В исследовании MRFIT риск летального исхода при внутричерепном кровоизлиянии у лиц с концентрацией общего холестерина <4,14 ммоль/л был в 3 раза выше, чем у лиц с высоким уровнем общего холестерина.
В исследовании APCSC было показано 20% (95% ДИ, 8% - 30%) снижение риска геморрагического инсульта на каждый 1 ммоль/л повышения уровня общего холестерина. [15].
Таким образом, уровень общего холестерина оказывает на риск инсульта разнонаправленное влияние: высокий уровень холестерина может сочетаться с бОльшим риском ишемического инсульта, низкий — с повышением риска геморрагического инсульта .
В большинстве исследований показана обратная зависимость уровня липопротеидов низкой плотности (ЛПНП) и риска ишемического инсульта [11].
Концентрация триглицеридов не влияет на риск инсульта [4].
Назначение липостатической терапии показано как для первичной, так и для вторичной профилактики инсульта.
В мета-анализе рандомизированных исследований было показано отсутствие пороговой концентрации липопротеидов низкой плотности (ЛПНП), при которой риск использования статинов превышает пользу [10].
Терапия статинами уменьшает риск развития сосудистых осложнений, включая первый инсульт. В мета-анализе результатов исследований, опубликованных к декабрю 2008 года (160 000 участников), было показано, что:
-
назначение статинов в комбинации с другими подходами к первичной и вторичной профилактике инсультов обеспечивает снижение риска развития всех видов инсульта на 18%;
-
в 10 исследованиях с участием 83,000 пациентов, статины не повышали риск развития геморрагического инсульта (относительный риск 1.03, 95% доверительный интервал 0.75-1.41). Однако, в подгруппе пациентов с клиническими проявлениями цереброваскулярного заболевания, большинство из которых принимали участие в исследовании SPARCL, отмечался повышенный риск развития геморрагического инсульта (относительный риск 1.73, 95% доверительный интервал 1.19-2.5);
-
эффективность статинов для вторичной профилактики инсульта оценивалась только в исследовании SPARCL (4731 амбулаторных пациентов, которым не выставлялся диагноз сердечно-сосудистого заболевания, без источников кардиогенной эмболии, перенесших инсульт или транзиторную ишемическую атаку за 1-6 месяцев до назначения лечения — аторвастатина в дозе 80 мг/сут или плацебо). Было показано, что снижение концентрации ЛПНП уменьшает риск развития повторного некардиоэмболического инсульта (относительный риск 0,84). (Amarenco P, Labreuche J. Lipid management in the prevention of stroke: review and updated meta-analysis of statins for stroke prevention. Lancet Neurol. 2009;8(5):453.). По результатам исследования пациентам, перенесшим транзиторную ишемическую атаку или ишемический инсульт, у которых не была диагностирована ишемическая болезнь сердца рекомендуется «агрессивная» липостатическая терапия статинами с целью снижения риска инсульта или острых сердечно-сосудистых заболеваний. Предпочтительным является использование аторвастатина в дозе 80 мг/сут. Для максимальной эффективности лечения необходимо добиваться снижения уровня ЛПНП на ≥50% от исходного или <1,8 ммоль/л.
РЕЗЮМЕ
-
Статины являются относительно безопасной группой лекарственных препаратов. Риск развития нежелательных явлений, требующих отмены препаратов, сопоставим с плацебо. Наиболее часто развиваются патологическое повышение активности печёночных ферментов (0,3-5%, часто в начале лечения, носит дозозависимый характер. Частота развития тяжёлых поражений печени у пациентов, принимающих статины не превышает таковую в общей популяции (Cohen DE, Anania FA, Chalasani N, An assessment of statin safety by hepatologists. Am J Cardiol. 2006;97(8A):77C.)
-
Оценка функции печени требуется только до начала терапии статинами, дальнейшие повторные исследования только по клиническими показаниям [6].
-
Миотоксическое действие статинов проявляется редко: частота миалгий составляет 2-11%, миозитов 0,5%, рабдомиолиза 0.1%. Рутинное измерение активности мышечно-специфичного фермента — креатинкиназы в динамике не рекомендуется, однако, оценка его уровня целесообразна в начале лечения статинами и при появлении у пациента жалоб на боли в мышцах и мышечную слабость.
-
Однако, эти симптомы могут отмечаться и у пациентов без патологического повышения активности ферментов.
-
Статины чаще вызывают повреждение мышечной ткани у пациентов с хронической почечной недостаточностью, заболеваниями печени с обструкцией желчных путей, а также у пациентов с гипотиреозом. В связи с последним фактом, перед началом лечения также требуется оценить уровень тиреотропного гормона (ТТГ) [7].
-
Приём статинов в течение нескольких десятков лет недостаточно изучен. Назначение статинов пациентам 20-30 лет требует индивидуального рассмотрения каждого случая.
-
Терапия статинами противопоказана беременным женщинам.
-
При назначении статинов пожилым пациентам необходимо принимать во внимание ожидаемую продолжительность жизни и набор хронических соматических заболеваний. При наличии серьёзной патологии — назначение препаратов этой группы не целесообразно.
Рекомендации по контролю уровня липидов и ферментов у пациентов, принимающих гиполипидемические препараты (Рекомендации ЕОК/ЕОА по лечению дислипидемий, European Heart Journal 2011;32:1769-1818, doi:10.1093/eurheartj/ehr158 по Рациональная Фармакотерапия в Кардиологии 2012; приложение №1)
Контроль уровня липидов
Как часто следует контролировать уровень липидов?
• Перед началом гиполипидемической терапии следует как минимум дважды выполнить анализ с интервалом 1-2 нед, за исключением состояний, требующих немедленного назначения лекарственных препаратов, например развитие ОКС
Как часто следует определять уровень липидов после начала лечения?
• Через 8 (±4) нед после начала приема лекарств
• Через 8 (±4) нед после изменения режима терапии до достижения целевых значений контрольных показателей
Как часто следует проверять уровень холестерина или липидов после достижения пациентом целевого или оптимального уровня холестерина?
• Один раз в год (за исключением случаев, когда наблюдаются проблемы с соблюдением указаний врача или возникают другие специфические причины для более частого выполнения анализов)
Контроль активности ферментов и действия при повышении уровней
Как часто следует контролировать уровень печеночных ферментов (АЛТ) у пациентов, принимающих гиполипидемические препараты?
• Перед началом лечения
• Через 8 нед после начала лекарственной терапии или после любого повышения дозы лекарственных средств
• После этого один раз в год, если уровень печеночных ферментов <3 ВГН —
Что делать в случае повышения уровня печеночных ферментов у пациентов, принимающих гиполипидемические препараты?
Если уровень ферментов не превышает 3 ВГН:
• Продолжать лечение
• Повторно проверить уровень ферментов через 4-6 нед
Если уровень ферментов превышает 3 ВГН:
• Прием статинов следует прекратить или снизить дозу препаратов, повторно проверив уровень ферментов через 4-6 нед
• После возвращения уровня АЛТ к норме следует попробовать с осторожностью вернуться к прежнему режиму лечения
Как часто следует контролировать уровень КФК у пациентов, принимающих гиполипидемические препараты?
Перед началом лечения:
• До назначения препарата
• Если уровень КФК >5 ВГН, лечение нельзя начинать, анализ следует повторить контроль
• В проведении рутинного контроля уровня КФК нет необходимости
• Уровень КФК следует проверить при появлении у пациента боли в мышцах
Следует проявить особую осторожность в отношении возможности развития миопатии и повышения уровня КФК при лечении пациентов из группы высокого риска: пожилые люди, принимающие сопутствующие лекарственные препараты, при наличии болезни печени или почек
Что делать в случае повышения уровня КФК у пациентов, принимающих гиполипидемические препараты?
Если уровень КФК >5 ВГН:
• Прекратить лечение, проверить функцию почек и проводить анализ каждые 2 недели до нормализации уровня КФК
• Оценить вероятность транзиторного повышения уровня КФК в связи с другими причинами, например, мышечным напряжением
• Оценить вероятность наличия других причин при сохранении высокого уровня КФК
Если уровень КФК ≤5 ВГН:
• При отсутствии какой-либо симптоматики со стороны мышц лечение следует продолжить (пациентов следует предупредить о необходимости без промедления сообщать о появлении каких-либо симптомов; уровень КФК следует определять регулярно)
• При наличии симптомов миалгии (миопатии) необходимо регулярно проверять уровень КФК
В каких случаях необходимо уменьшить дозу статинов?
Безопасный минимальный уровень показателей липидного обмена при приёме статинов в высокой дозе остаётся предметом обсуждения.
Рекомендуется уменьшить дозу, если уровень холестерина ЛПНП ниже 0,65 ммоль/л. По данным отдельных исследований, снижение показателя даже ниже 0,39 ммоль/л не сопровождалось значимым повышением побочных эффектов [16].
В каких случаях необходимо прекратить приём статинов?
Приём статинов нецелесообразен, если у пациента грубые когнитивные и/или двигательные нарушения (деменция, нуждается в уходе), а также, если ожидаемая продолжительность жизни пациента не превышает года (тяжёлые соматические и неврологические заболевания). За этот короткий промежуток времени дискомфорт, связанный с приёмом препаратов, превышает пользу от их профилактического действия.
Советы врачу по улучшению степени приверженности пациента проводимому лечению
-
Установить хорошие взаимоотношения с пациентом
-
Необходимо убедиться в том, что пациент понимает, как изменения образа жизни отражаются на течении сердечно-сосудистых заболеваний, и использовать это для достижения соглашения о необходимости изменения образа жизни
-
Необходимо выяснить наличие потенциальных препятствий для достижения этих изменений
-
Следует совместно с пациентом разработать план изменения образа жизни, который должен быть реальным и оптимистическим
-
Необходимо всячески одобрять старание пациента соблюдать предписанные назначения
-
В случае необходимости следует привлекать к участию в лечении других специалистов
-
Необходимо разработать программу долгосрочных визитов
-
Советы по улучшению приверженности пациента режиму лечения с применением нескольких препаратов
-
По возможности следует упростить режим приема препаратов путем снижения кратности приема и отменить другие малоэффективные лекарства
-
Следует отдавать предпочтение более дешевым (по цене) лекарственным средствам
-
Назначения следует сопровождать четкими устными и письменными инструкциями
-
С пациентом необходимо побеседовать о важности соблюдения медицинских рекомендаций
-
Режим терапии следует максимально привести в соответствие с образом жизни пациента
-
Пациента следует привлекать в качестве партнера при обсуждении плана лечения
-
Полезно использовать современные информационные технологии (системы напоминаний, заметки, дневник самоконтроля, обратная связь, поощрение)
1Возможно повышение сывороточного уровня триглицеридов у пациентов с исходной гипертриглицеридемией
2Повышение на 20% отмечается у пациентов с очень высоким уровнем триглицеридов, повышение на 5% более характерно для пациентов с низким уровнем триглицеридов.
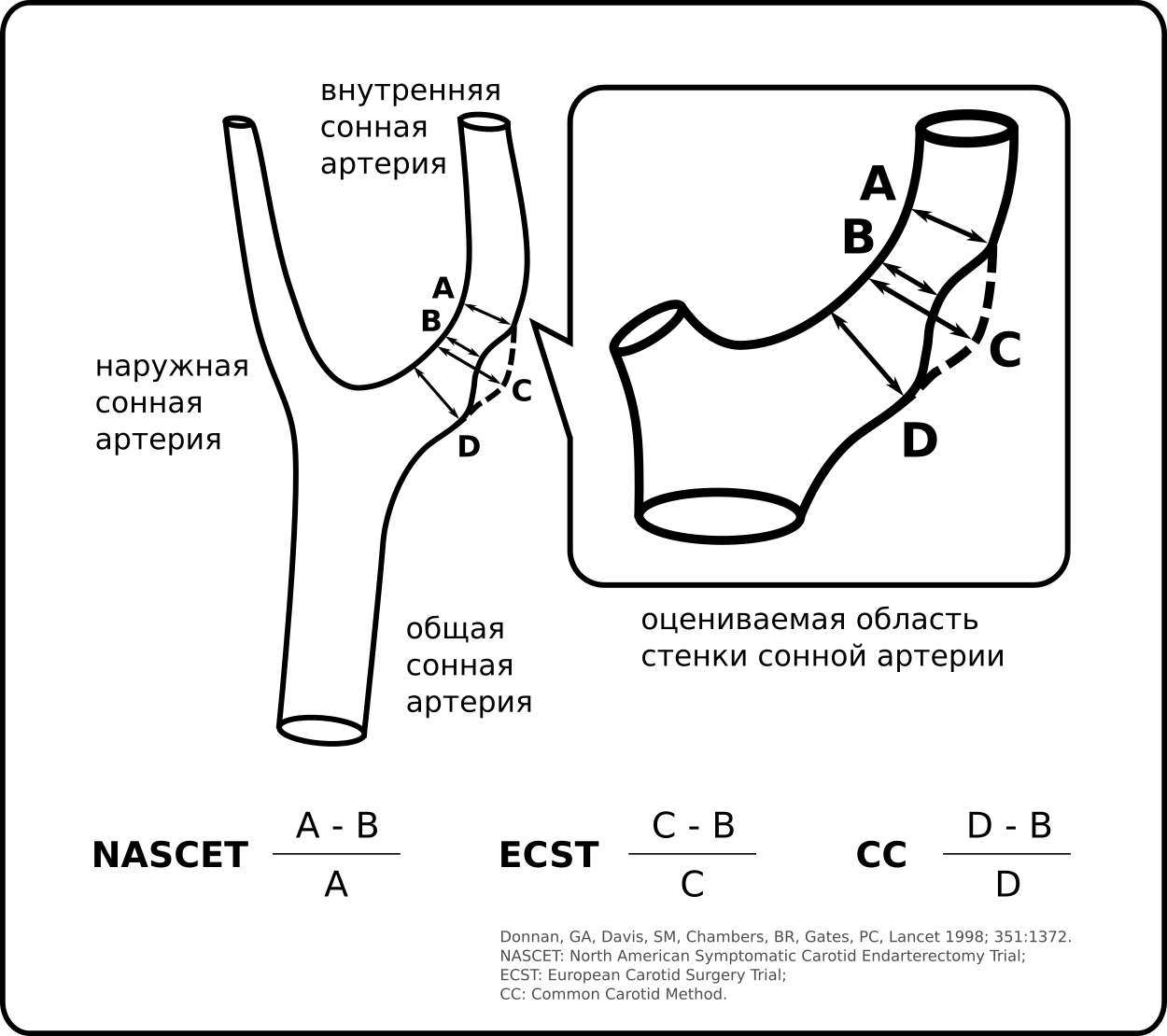 Подходы к определению стенозов брахиоцефальных артерий
Подходы к определению стенозов брахиоцефальных артерий
NASCET — диаметр просвета сосуда, оставшийся в наиболее узкой части стенозированного участка соотносится с диаметром просвета интактного участка внутренней сонной артерии дистальнее стеноза.
ECST — диаметр просвета в наиболее узкой части стенозированного участка соотносится с расчётной величиной диаметра просвета сосуда.
CC — диаметр наиболее узкой части стенозированного просвета соотносится с диаметром просвета проксимального участка общей сонной артерии.
Приблизительное соответствие степени стеноза внутренней сонной артерии при использовании определений NASCET и ESCT в соответствии с прямыми сравнениями
| NASCET | ESCT |
|---|---|
| 30 | 65 |
| 40 | 70 |
| 50 | 75 |
| 60 | 80 |
| 70 | 85 |
| 80 | 91 |
| 90 |
97 |
Ведение пациентов со стенозами сонных артерий
Асимптомные
- Все пациенты с диагностированным атеросклеротическим поражением сонных артерий должны получать антитромботический препарат (аспирин/плавикс/варфарин/новый оральный антикоагулянт) и статин (вне зависимости от концентрации холестерина в сыворотке крови)
- Симптомными случаями поражения брахиоцефальных артерий считаются только при развитии транзиторной ишемической атаки, инсульта или преходящей слепоты в течение последних 6-ти месяцев в бассейне поражённого сосуда на его стороне
- При наличии асимптомного поражения сонных артерий <70% показано оптимальное медикаментозное лечение (антитромботические препараты, статины, коррекция факторов риска инсульта)
- У пациентов мужского пола <75 лет с асимптомным поражением сонных артерий >70% рассматривается возможность хирургического лечения
- У женщин с асимптомным атеросклеротическим поражением сонных артерий >70% оперативное лечение показано только в молодом возрасте и пациенткам без значимых соматических и неврологических нарушений
Симптомные
- Все пациенты с симптомным поражением сонных артерий <50% должны получать оптимальную медикаментозную терапию (антитромботические препараты, статины, коррекция факторов риска инсульта)
- Всем пациентам с симптомным поражением сонных артерий >50% должно проводится хирургическое лечение.
- Методом выбора является каротидная эндартерэктомия.
- Стентирование проводится только пациентам с симптоматическим стенозом и высоким риском открытого хирургического вмешательства.
- Наибольшая эффективность хирургического вмешательства у пациентов с симптомным поражением отмечается в течение первых 14 дней с развития симптома
Не существует хирургического метода лечения с доказанной эффективностью для профилактики развития инсульта у пациентов с полной окклюзией сонных артерий.
Таким образом, является важным адекватно различать полную окклюзию сосудов и случаи с сохранным кровотоком, в которых реваскуляризация может принести некоторую пользу.
Определение
Известный набор факторов риска сердечно-сосудистых заболеваний в равной степени предрасполагает к поражениям как крупных, так и мелких сосудов органов.
Первые могут сопровождаться тяжёлыми острыми клиническими состояниями:
- инсультами и транзиторными ишемическими атаками,
- инфарктом миокарда,
- тромбозом периферических артерий.
Вторые - микрососудистым осложнениями: хроническому сосудистым поражением головного мозга, нефросклерозом, ангиопатия сетчатки. В нашей стране состояние, развившееся вследствие патологии микрососудов головного мозга традиционно обозначают термином «дисциркуляторная энцефалопатия». Дисциркуляторная энцефалопатия (ДЭП) предполагает хроническое многоочаговое и/или диффузное поражение головного мозга сосудистой природы. В патогенезе ДЭП ведущая роль патологии мелких артерий и артериол (микроангиопатии). Основные симптомы ДЭП объединяются в следующие группы:
- Когнитивные нарушения;
- Аффективные нарушения;
- Полиморфные двигательные нарушения:
- пирамидные,
- экстрапирамидные,
- Псевдобульбарные расстройства,
- Мозжечковые расстройства,
- Вестибулярные расстройства;
- Вегетативные расстройства;
- Недержание мочи*
*Отмечается на поздних стадиях хронического сосудистого поражения головного мозга [37]
Диагноз
Критерии диагноза дисциркуляторной энцефалопатии[2]
- Объективно выявляемые нейропсихологические и неврологические симптомы (в порядке убывания значимости: когнитивные и эмоционально-волевые нарушения, нарушения ходьбы, координации движений, признаки пирамидной недостаточности);
- Признаки цереброваскулярного заболевания, включающие
- факторы риска сердечно-сосудистых осложнений (артериальная гипертензия, гиперлипидемия, сахарный диабет, нарушения сердечного ритма и др.), и/или
- анамнестические признаки - ступенчатое прогрессирование симптомов, связь с гипертоническими кризами, нарушениями сердечного ритма, и/или
- инструментально подтвержденные признаки поражения мозговых сосудов и сосудистые изменения вещества головного мозга (последствия инфарктов и/или хронические изменения вещества головного мозга);
- Свидетельства причинно-следственной связи между пунктами 1 и 2:
- соответствие динамики нейропсихологического и неврологического дефицита особенностям течения цереброваскулярного заболевания (тенденция к прогрессированию с чередованием периодов резкого ухудшения, частичного регресса и относительной стабилизации);
- соответствие выявляемых при КТ/МРТ изменений вещества мозга сосудистого генеза ведущим клиническим проявлениям;
- исключены другие заболевания, способные объяснить набор симптомов у пациента.
Доказательство причинно-следственной связи является наиболее уязвимым звеном в установлении диагноза. В исследованиях указывается также на несогласованность в выявлении значимых сосудистых изменений на МРТ головного мозга различными исследователями.
В англоязычной литературе наиболее сходным с ДЭП термином является “cerebral small vessel disease” – лакунарные инфаркты/лакуны, лейкоареоз, микрокровоизлияния.
Патогенез
Наиболее значимым фактором риска поражения мелких сосудов головного мозга является артериальная гипертензия [23]. При дисциркуляторной энцефалопатии встречаются как первичные сосудистые, так и вторичные дегенеративные изменения вещества головного мозга.
Выделяют несколько видов патологических изменений вещества головного мозга, ассоциированных с хроническим ишемическим повреждением [2,29,42].
- постинфарктные очаги («неполные» и «немые» инфаркты),
- лейкоареоз (диффузные изменения белого вещества головного мозга),
- множественные лакуны,
- расширенные периваскулярные пространства,
- Последствия кровоизлияний,
- Атрофия вещества головного мозга,
Атеросклероз поражает артерии эластического и крупные артерии мышечного типа. В большинстве случаев атеросклероз приводит к развитию острых нарушений мозгового кровообращения с быстрым развитием выраженных очаговых симптомов. В патогенезе хронических сосудистых заболеваний головного мозга основное значение имеет поражение микроциркуляторного русла. Оно образовано терминальными ветвями крупных артерий каротидного и вертебрально-базилярного бассейна, а также притоками церебральных вен. Артерии микроциркуляторного русла подвержены изменениями при резких перепадах артериального давления поскольку на этом уровне не образуются анастомозы.
Болезнь мелких сосудов или микроангиопатия может иметь различной этиологии:
- Дегенеративная: например, липогиалиноз (артериосклероз) с развитием лакунарных инфарктов;
- Наследственная: церебральная аутосомная доминантная артериопатия с лакунарными инфарктами (CADASIL);
- Митохондриальная: митохондриальная энцефалопатия, лактат-ацидоз с инсультоподобными эпизодами (MELAS);
- Болезни накопления: накопление амилоида при церебральном амилоидозе;
- Первичную или связанную с неуточнённой причиной (предполагаются иммунологические, воспалительные изменения, интоксикация).
В ряде случаев, нарушения микроциркуляции могут быть вызваны патологией со стороны системы крови, без поражения кровеносных сосудов. Истинная полицитемия, гемоглобинопатии или протеинопатии могут повышать вязкость крови, что приводит к сопротивлению кровотоку и агрегации форменных элементов, является причиной церебральной ишемии. В редких случаях возможно развитие микроэмболии. Важными дополнительными факторами могут быть нарушения обмена веществ, прежде всего, сахарный диабет и нарушение венозного оттока.
Нарушения ауторегуляции мозгового кровообращения являются как причиной, так и следствием поражения микрососудов, принимая участие в порочном круге патологических изменений.
Лейкоареоз — нейровизуализационный термин (снижение рентгеновской плотности на КТ головного мозга, повышение интенсивности сигнала по данным МРТ в Т2/FLAIR режимах), описывающий неспецифические изменения подкоркового белого вещества головного мозга. Выявляются двусторонние очаговые, иногда сливные изменения. В основе лейкоареоза лежит поражение мелких артерий и артериол вследствие липогиалиноза (также обозначается как артериосклероз) и микроатероматоза [11].
Факторами риска развития лейкоареоза являются возраст, повышенное артериальное давление и сахарный диабет [18]. Повышение внутрижелудочкового давления рассматривается в качестве дополнительного механизма развития лейкоареоза, оно приводит к нарушению микроциркуляции в прилегающих к желудочкам участках головного мозга. У пациентов с нормотензивной гидроцефалией отмечаются распространённые изменения подкоркового белого вещества [21].
Доказана связь распространенности диффузных изменений белого вещества головного мозга с выраженностью депрессии и когнитивных нарушений [9,43].
В препаратах головного мозга лейкоареоз часто сочетается с расширением периваскулярных (Вирхова-Робина) пространств — криблюрами (‘etát criblé’). Этот феномен связывают с повторными эпизодами ишемии и плазматического пропитывания участков ткани, окружающих микрососуды.
Липогиалиноз - дистрофический процесс, поражающий пенетрирующие артерии и артериолы диаметром до 200 мкм. Протекает под действием повышения артериального давления, гипергликемии, а также вследствие возрастных изменений. Повышение тканево-сосудистой проницаемости в субэндотелиальном пространстве сосуда приводит к поступлению туда белков плазмы и адсорбции их на изменённых волокнистых структурах соединительной ткани с последующей преципитацией и образованием белка гиалина. В последующем, гиалин оттесняет и разрушает эластичную мембрану, средняя оболочка истончается, и перфорирующая артерия приобретает вид стекловидной трубочки. Просвет артерии резко сужается, возможно развитие окклюзии.
При развитии липогиалиноза фоне сахарного диабета субэндотелиально часто откладывается не только гиалин, но и липиды. Сосудистая стенка инфильтрируется макрофагами с включениям фагоцитированных липидов — пенистыми клетками. В изменённых тканях происходит отложение фибриноида (сложного вещества, состоящего из белков и полисахаридов, распадающихся коллагеновых волокон, межклеточного вещества и плазмы крови). В неблагоприятных условиях происходит гибель окружающих тканей — фибриноидный некроз. Этот патологических процесс выявляется в артериолах и капиллярах головного мозга, сетчатки и почек часто сочетается с гиалинозом.
Этот патологический процесс, видимо является реактивным феноменом. Он не рассматривается, как ведущая причина гипертонического внутричерепного кровоизлияния, так как в препаратах головного мозга в случаях острого внутричерепного кровоизлияния не обнаруживается на отдалении от гематомы. В лабораторных исследованиях выраженные изменения по типу фибриноидного некроза выявлялись вокруг стереотаксически введенных тромбов в опытах у грызунов, что могло указывать на его реактивное происхождение.
Вследствие нарушения работы ассоциации эндотелиоцит-глиальная клетка (астроцит)-нейрон («нейроваскулярное звено») страдают механизмы ауторегуляции мозгового кровотока на уровне капилляров и микроартериол. Это приводит к сужению диапазона допустимых показателей перфузии. Из-за того, что мелкие сосуды утрачивают способность расширяться, становится невозможным перераспределение кровотока в пользу активно работающих отделов мозга, а это в свою очередь приводит к их функциональной инактивации, а затем – и к необратимому повреждению. Преимущественное поражение белого вещества в перивентрикулярном и глубинных отделах при церебральной гипоперфузии объясняется особым характером их кровоснабжения сосудами терминального типа, не имеющими коллатералей.
Клетки нервной ткани различаются по чувствительности к ишемии. При нарушении кровотока, некротические изменения развиваются сначала в нейронах, затем олигодендроцитах, миелинизированных аксонах, астроцитах и наконец в эндотелиальных клетках [38]. После гибели наиболее чувствительных типов клеток — нейронов и олигодендроцитов, относительно резистентные к ишемии астроциты, выполняющие в головном мозге опорную функцию, замещают дефект за счёт увеличения в объёме своих отростков. Формируется глиальный рубец («неполный» инфаркт») [33]. При тотальной гибели всех элементов участка мозговой ткани формируется участок некроза (лакуна), на периферии регенерация глиальных клеток формирует его «оболочку».
В патологоанатомических исследованиях отмечена связь липогиалиноза мелких артерий с лакунарными инфарктами головного мозга. Указывается на более высокую распространённость расширенных периваскулярных пространств у пациентов с сосудистой деменцией, чем у пациентов с болезнью Альцгеймера [30]. У здоровых пожилых пациентов с выявленными расширенными периваскулярными пространствами отмечались худшие результаты тестирования когнитивных функций.
Микроатероматоз — атеросклеротическое поражение артериол, приводит к развитию более крупных лакунарных инфарктов. В зависимости от локализации, инфаркты могут проявляться клиникой инсульта, но чаще (примерно в 80 % случаев) протекают субклинически («немые» инфаркты)[40]. У части пациентов основные патологические процессы вызываются церебральной амилоидной ангиопатией (ЦАА) — отложением амилоидных пептидов (прежде всего Аβ -амилоида) в мышечной оболочке и адвентиции микрососудов и сосудов среднего калибра, значительно реже в стенках капилляров и вен.
Частота выявления амилоидоза церебральных артерий на аутопсии с возрастом увеличивается: на основании серии из 784 аутопсийных материалов, признаки умеренной и тяжёлой ЦАА встречались с частотой 2.3% в возрасте от 65 до 74 лет, 8.0% в возрасте от 75 до 84 лет, и 12.1% в возрасте старше 85 лет [14].
Значимых половых различий во встречаемости амилоидоза не выявлено. Несмотря на то, что вопрос связи ЦАА с артериальной гипертензией продолжает обсуждаться, очевидно, что в большом количестве случаев у пациентов при жизни отмечалось нормальное артериальное давление[3].
Предполагается, что амилоидные пептиды, блокируют отток по переваскулярным пространствам, выполняющим в головном мозге дренажную функцию. Повышение ломкости стенки сосудов при отложении амилоида значительно увеличивает риск внутримозговых кровоизлияний. Они, как правило, имеют небольшие размеры и располагаются кнаружи от внутренней капсулы, в белом веществе больших полушарий, для сравнения, гипертонические кровоизлияния поражают преимущественно область подкорковых ядер. В связи с таким расположением микрокровоизлияний при ЦАА, подкорковые структуры остаются относительно интактными, поэтому, экстрапирамидные симптомы не характерны для клиники этого состояния. По данным Фрамингемского исследования установлена связь деменции и внутримозговых микрокровоизлияний, которая не зависела от выраженности других сердечно-сосудистых факторов риска . Наличие ЦАА предполагается у пациентов старше 55-60 лет с множественными лобарными кровоизлияниями без другой явной причины.
Бостонские критерии для кровоизлияний, связанных с церебральной амилоидной ангиопатией [19]
- Достоверный случай
- По результатам полного посмертного патологоанатомического исследование выявлены:
- Лобарные, кортикальные и субкортикальные кровоизлияния.
- Выраженные признаки ЦАА с поражением сосудов.
- Нет указаний на другие заболевания, объясняющие результаты исследования.
- Вероятный случай ЦАА, с патологанатомическим подтверждением
- Клинические данные и патологоанатомическое исследование образца ткани (эвакуированная гематома или биоптат участка коры головного мозга) указывают на:
- Лобарные, кортикальные и субкортикальные кровоизлияния.
- Отдельные признаки ЦАА с поражением сосудов.
- Нет указаний на другие заболевания, объясняющие результаты исследования.
- Вероятный случай ЦАА
- Клинические данные, результаты КТ и/или МРТ:
- Множественные лобарные, кортикальные и субкортикальные кровоизлияния (допускается наличие кровоизлияний в мозжечок)
- Возраст ≥55 лет.
- Нет указаний на другие причины кровоизлияний*
- Возможный случай ЦАА
- Клинические данные, результаты КТ и/или МРТ:
- Множественные лобарные, кортикальные и субкортикальные кровоизлияния (допускается наличие кровоизлияний в мозжечок)
- Возраст ≥55 лет
- Нет указаний на другие причины кровоизлияний*
*приём варфарина с превышением целевого значения МНО (> 3,0), перенесённые инсульты и черепно-мозговые травмы, опухоли головного мозга, сосудистые аномалии и васкулиты, патология системы крови, коагулопатии [41].
У пациентов с подозрением на церебральную амилоидную ангиопатию, развитие острых и транзиторных неврологических нарушений может быть связано с геморрагическими осложнениями, что стоит принимать во внимание при планировании их обследования.
У пациентов с выраженным лейкоареозом и множественными лакунарными инфарктами в отсутствии факторов риска сосудистых заболеваний стоит предположить наличие церебральной аутосомно-доминантной артериопатии с подкорковыми инфарктами и лейкоэнцефалопатией (CADASIL) — наследственного заболевания, вызванного мутацией гена Notch 3 на 19-й хромосоме. У трети пациентов, страдающих этим заболеванием, отмечается мигрень с аурой, которая рассматривается как раннее проявление заболевания. Приблизительно у 75% лиц, носителей мутации, в конечном счёте развивается деменция[27].
Таким образом, хронические сосудистые поражения головного мозга определяются большим количеством факторов риска, как генетических, так и средовых. Профиль факторов риска развития дисциркуляторной энцефалопатии и инсульта не тождественны. Поражение артерий мозга может быть и изолированным - встречается у пациентов без поражения прецеребральных артерий и артериальной гипертензии.
Рисунок 2 Динамика атрофических изменений вещества головного мозга
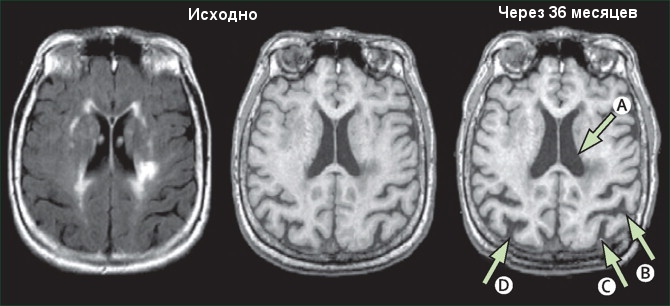
В патогенезе развития основных симптомов дисциркуляторной энцефалопатии (когнитивных нарушений, нарушений ходьбы, пирамидных и мозжечковых знаков, псевдобульбарного синдрома) лежит разобщение корковых и подкорковых структур вследствие поражения подкоркового белого вещества больших полушарий. Нарушается работа корково-подкорковых кругов, обеспечивающих последовательную избирательную активизацию отдельных участков коры головного мозга при выполнении сложных многоэтапных действий, поддерживающих общий уровень активности коры, несущих информацию для коррекции действий на стадии афферентного синтеза и исполнения (функции I [энергетического] и III [программирование, регуляция и контроль] блоков по А.Р.Лурия).
Клинико-нейровизуализационные соответствия
Термин «энцефалопатия» предполагает наличие не только субъективных жалоб, но и объективных признаков органического поражения мозга, выявляемых при неврологическом или нейропсихологическом исследовании [2]. Вместе с тем, обнаружение подобных признаков, даже вкупе с сосудистыми факторами риска, клиническими или параклиническими признаками цереброваскулярной патологии является необходимым, но недостаточным признаком ДЭП. Важнейшим принципом диагностики ДЭП должна стать констатация причинно-следственной связи между имеющимися у больного клиническими проявлениями и цереброваскулярным заболеванием.
Подобный принцип впервые был заложен в критерии клинической диагностики сосудистой деменции NINDS-AIREN. Представляется, что только следование этому принципу позволит избежать гипердиагностики ДЭП и отделить случаи ДЭП от нейродегенеративных заболеваний, широко представленных у лиц пожилого возраста (в первую очередь от болезни Альцгеймера или болезни Паркинсона, набор симптомов которых на начальных стадиях может соответствовать последствиям хронического сосудистого поражения головного мозга).
Доказательством причинно-следственной связи могут служить:
- характеристики отдельных симптомов (нейродинамический или дизрегуляторный характер когнитивного дефекта, сочетание когнитивных с аффективными нарушениями, а также неврологическими нарушениями, свидетельствующими о вовлечении глубинных отделов мозга, в том числе дизартрией, экстрапирамидными знаками, нарушением ходьбы/постуральной устойчивости и др.),
- течение заболевания со ступенеобразным прогрессированием нарушений,
- соответствие клинической картины данным дополнительных методов исследования, в первую очередь компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) головного мозга,
- отсутствие клинических или параклинических признаков другого заболевания, которое может объяснить клиническую картину.
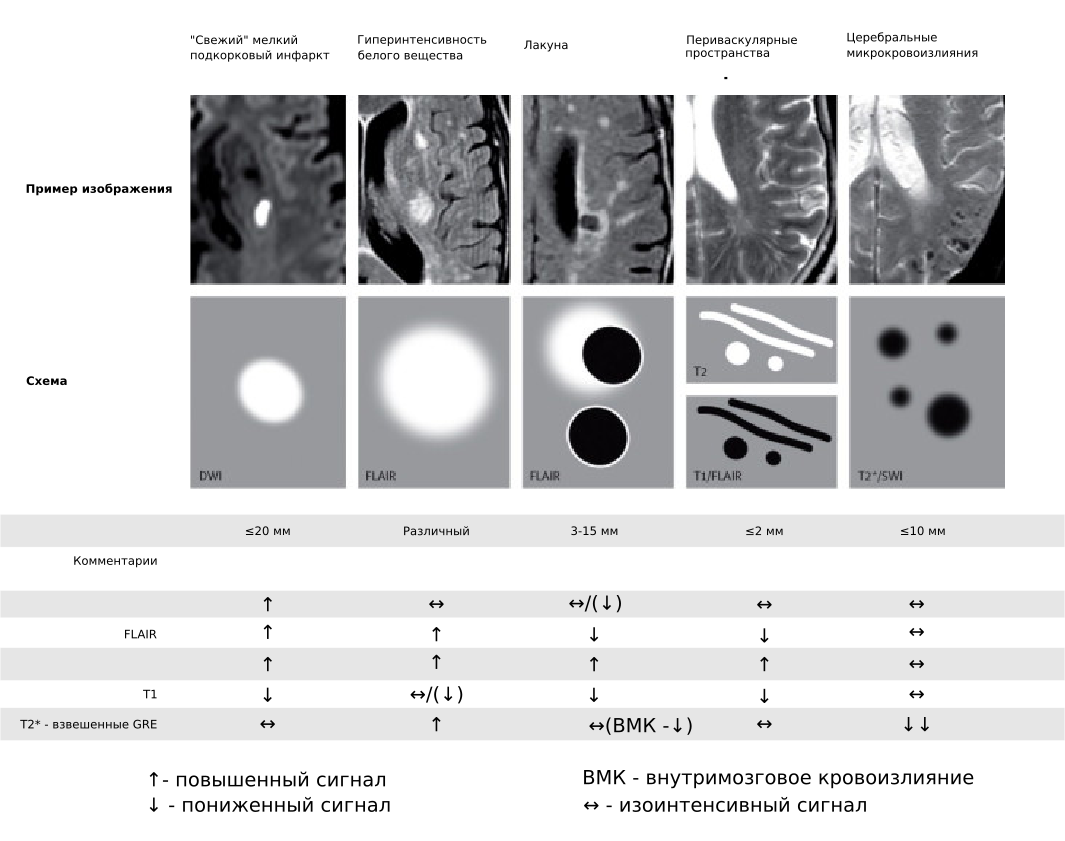
КТ или МРТ головного мозга при ДЭП могут выявить: двустороннее более или менее симметричное диффузное поражение белого вещества (лейкоареоз) в перивентрикулярной зоне, зрительной лучистости, семиовальном центре; множественные лакунарные очаги (размером 3-15 мм) в базальных ганглиях, таламусе, мосте, мозжечке, внутренней капсуле, белом веществе лобных долей; более крупные корковые и подкорковые инфаркты, отражающие патологию крупных артерий. Церебральная атрофия, выявляемая при КТ или МРТ у больных ДЭП, обычно сопровождает лейкоареоз, лакунарые или территориальные инфаркты [2]. Как правило, расширение желудочковой системы при ДЭП более выражено, чем расширение корковых борозд, и может отражать не только убыль мозгового вещества в глубинных отделах мозга, но и, возможно, снижение резистентности перивентрикулярных тканей к ликвородинамическим воздействиям [2].
В ряде исследований выявлена связь между тяжестью и/или локализацией нейровизуализационных изменений и выраженностью когнитивных и двигательных нарушений [18]. Так, показано, что умеренное когнитивное расстройство возникает, когда распространенность лейкоареоза превышает как минимум 10% белого вещества полушарий, а деменция – если распространенность лейкоареоза превысит 1/4 объема белого вещества полушарий. При наличии лакун выраженность когнитивных нарушений зависит не столько от числа лакунарных очагов, сколько от их локализации (глубинные отделы лобных долей, головка хвостатого ядра и переднее бедро внутренней капсулы, таламус). Выраженность когнитивных нарушений увеличивается при двустороннем поражении указанных структур и сочетании лакунарных очагов с лейкоареозом. Более того, должно быть соответствие между нейровизуализационными изменениями и профилем когнитивных нарушений. Например, в отсутствие соответствующих корковых очагов на КТ и МРТ у пациентов не должны выявляться признаки очагового поражения корковых функций: афазии, апраксии и агнозии. Отмечена также связь между распространенностью лейкоареоза, особенно в передних отделах мозга, локализацией лакунарных очагов в чечевицеобразном ядре и выраженностью нарушений ходьбы и равновесия.
Выраженность когнитивных и двигательных нарушений при ДЭП коррелирует и со степенью расширения боковых желудочков и особенно их передних рогов. С другой стороны, отсутствие сосудистых изменений на МРТ при клинической картине I-III стадий ДЭП и КТ при клинической картине II – III стадий ДЭП может заставлять усомниться в диагнозе. Данные КТ и МРТ имеют значение не только в диагностике ДЭП, но и могут помочь отслеживать динамику заболевания, быть маркером эффективности мер по коррекции факторов риска сердечно-сосудистых осложнений [2]. Отдельные нейровизуализационные феномены считаются нормальным проявлением старения: [12, 42]
- Лёгкое или умеренное снижение объёма мозговой ткани:
- Увеличение желудочков
- Расширение третьего желудочка
- Расширение борозд головного мозга, прежде всего за счёт истончения коры.
- Одинаковая выраженность изменений лобных и теменных долей.
- Лёгкая атрофия медиальных отделов височной доли.
- Полости в гиппокампальной борозде.
- Увеличенные периваскулярные пространства Вирхова–Робина:
- область подкорковых ядер, около передней спайки,
- белое вещество семиовального центра (подкоркового белого вещества), в верхней части
- средний мозг.
- Изменения в сосудистой стенке:
- удлинение и патологическая извитость артерий (например, базилярная артерия),
- истончение стенки и кальцификация (например, сифона сонной артерии).
- Изменения в мозговой ткани:
- точечные или сливные изменения подкоркового белого вещества,
- лакунарные инфаркты и/или микрокровоизлияния (при отсутствии клинической картины, как случайные находки при проведении нейровизуализации),
- накопление железа в бледном шаре, скорлупе, зубчатом ядре.
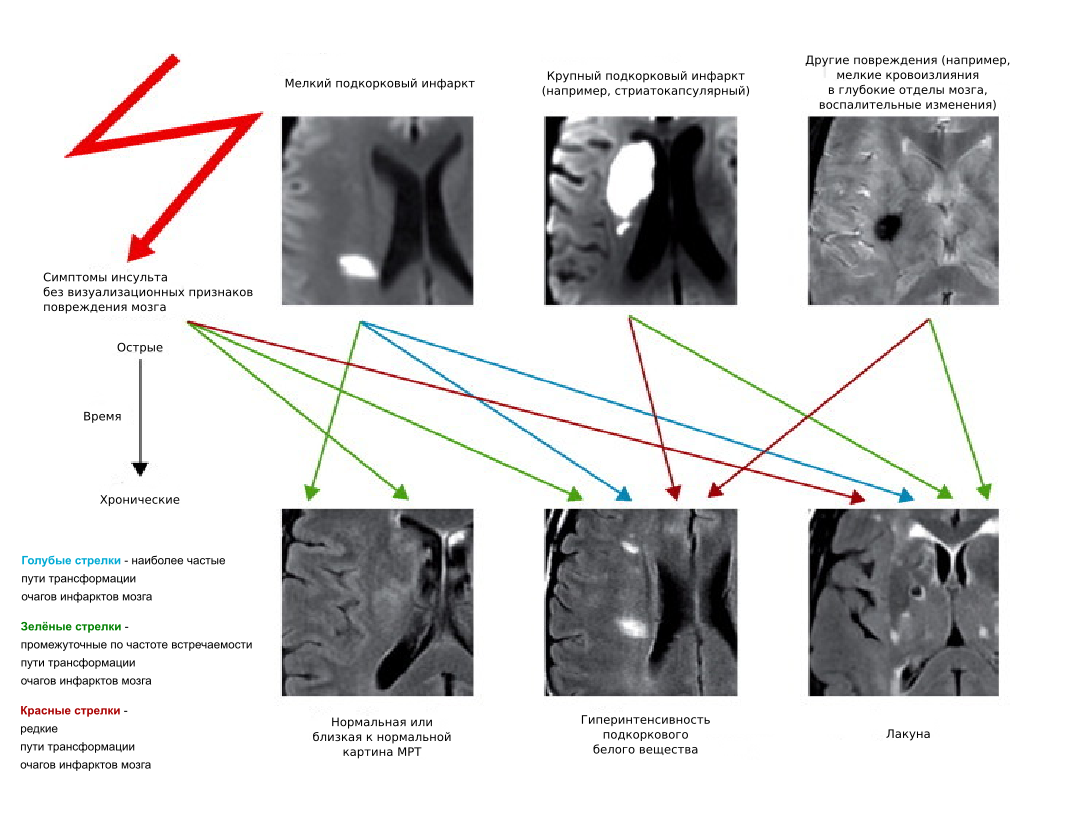
Рисунок 3 Признаки поражения мозга, вызванного патологией мелких сосудов, по данным МРТ
Клиника
Когнитивные нарушения
Ведущим клиническим синдромом дисциркуляторной энцефалопатии являются когнитивные нарушения, на основании которых определяется стадия (степень тяжести) заболевания. Не существует нейропсихологических нарушений, патогномоничных для дисциркуляторной энцефалопатии. Функциональные возможности пациентов определяются больше общим состоянием пациента и подвержены колебаниями в течение времени. Н.И. Пироговым описана метеозависимость пациентов с травматическими органическими поражениями головного мозга (метеопатический симптом Пирогова). Влияние внешних и внутренних неблагоприятных факторов на сосудистых пациентов сходно с классическим описанием. Выделяется три стадии ДЭП.
I стадия (лёгкая)
Повышенная утомляемость от умственной работы, умеренное снижение оперативной памяти и объема восприятия. Преобладают субъективные симптомы (головная боль, головокружение, шум в голове, повышенная утомляемость, снижение внимания, неустойчивость при ходьбе, раздражительность, нарушение сна). При осмотре можно отметить лишь легкие псевдобульбарные проявления, оживление сухожильных рефлексов, анизорефлексию, снижение постуральной устойчивости, замедление ходьбы. При нейропсихологическом исследовании выявляются умеренные когнитивные нарушения лобно-подкоркового характера (нарушения памяти, внимания, познавательной активности) или неврозоподобные расстройства, главным образом астенического типа. У некоторых больных наблюдается снижение работоспособности.
В отечественной практике выделяются лёгкие когнитивные нарушения. Часть пациентов предъявляют когнитивные жалобы, при этом, если выполнение задания не предполагает учёта времени, пациенты справляются с ним. Нарушения памяти и внимания не оказывают влияния на способность пациентов ориентироваться в пространстве и времени. Профессиональная и бытовая деятельность не страдают.
Более лёгкой формой являются субклинические когнитивные нарушения (также обозначаются, как субъективные, латентные) , когда их признаки ограничиваются жалобами пациентов, но не подтверждаются результатами тестирования. Важным замечанием является возможность связи жалоб на снижение памяти с депрессивным расстройством. Степень сосудистого поражения головного мозга на первой стадии ДЭ не предполагает наличия очаговых неврологических нарушений, но допускает присутствие рассеянной микроочаговой симптоматики.
II стадия (умеренная)
Формирование клинических синдромов, существенно снижающих функциональные возможности больного: когнитивных нарушений, связанных с дисфункцией лобных долей и выражающихся в снижении памяти, замедлении психических процессов, нарушении внимания, мышления, способности планировать и контролировать свои действия, выраженных вестибуломозжечковых расстройств, псевдобульбарного синдрома, постуральной неустойчивости и нарушения ходьбы. В клинической картине выявляется так называемый синдром умеренных когнитивных расстройств (УКР). Первоначально термин (mild cognitive impairment) имел отношение к нарушениям памяти и использовался для обозначения состояния, предшествующего развитию болезни Альцгеймера (БА). В настоящее время в зарубежной литературе существует термин для обозначения умеренных когнитивных нарушений, связанных с цереброваскулярным заболеванием – 'vascular cognitive impairment, no dementia' (VCIND) (УКР – промежуточное состояние между нормальным когнитивным статусом и деменцией, не сопровождающееся нарушениями повседневной активности). По результатам мета-анализа нескольких исследований распространённость когнитивных нарушений у лиц старше 70 лет оценивается приблизительно в 20%.[1].
УКР неоднородны по клиническим проявлениям, этиологии и прогнозу. На основании этиологии, выделяют как минимум три основных варианта цереброваскулярного УКР (О.С.Левин, 2010):
- Постинсультное (выявляется примерно у половины пациентов, перенесших ишемический инсульт).
- Связанное с патологией мелких мозговых сосудов.
- Возникающее на фоне стенозирующего атеросклероза магистральных артерий головного мозга.
На основании нейропсихологического профиля выделяется несколько вариантов умеренного когнитивного расстройства (R.C.Petersen (2001, 2004)):
- Амнестический тип с характерным дефектом эпизодической памяти, связанным с нарушением запоминания (в том числе опосредованного) и узнавания (мнестическим синдромом «гиппокампального типа»).
- Дизрегулярторный (лобный) тип, характеризующийся преобладанием дисфункции лобных долей, которая может быть связана с первичной патологией лобной коры или является вторичной по отношению к патологии глубинных структур (подкорково-лобный синдром); при этом типе возможно вторичное снижение памяти с дефектом воспроизведения, но сохранным узнаванием и опосредованным воспоминанием; характерно также снижение речевой активности (особенно уменьшение числа фонетически опосредованных ассоциаций). Этот вариант наиболее часто встречается хронических цереброваскулярных заболеваниях. Сходные нарушения отмечаются у пациентов с депрессией и другими аффективными нарушениями, черепно-мозговой травмой, на ранней стадии алкогольной энцефалопатии, при нейродегенеративных заболеваниях.
- Комбинированный (мультифункциональный) тип, характеризующийся сочетанием амнестического синдрома гиппокампального типа (с нарушением опосредованного запоминания и узнавания) с расстройством регуляторных и других когнитивных функций.
- УКР с преобладанием нарушением какой-либо иной когнитивной сферы, например зрительно-пространственных или речевых (дисфатических) нарушений.
Первый вариант УКР связан с развитием БА и рассматривается как ранняя, «продромальная» фаза заболевания, последующие два не обладают нозологической специфичностью, последний - при дальнейшем развитии может траснформироваться в деменцию с тельцами Леви (ДТЛ).
Сочетание наиболее часто встречающихся нейродегенеративных заболеваний (БА и болезни Паркинсона) с распространёнными поражениями белого вещества головного мозга делает затруднительным нозологический диагноз у пациентов с УКР.
МР-картина головного мозга у пациентов с сочетанием нейродегенеративных заболеваний и хронических сосудистых изменений головного мозга не отличается от таковых у пациентов, имеющих только сосудистое поражение головного мозга. Данные визуализации не помогают в установлении причины развития УКР. Для проведения дифференциального диагноза необходимы дополнительные данные (анамнез, динамическое наблюдение за пациентом).
Синдром умеренного когнитивного расстройства необходимо дифференцировать с другими состояниями:
- психическими заболеваниями (при депрессии у пациентов могут преобладать когнитивные жалобы, а не жалобы на нарушения настроения; тестирование также может выявлять когнитивное снижение, которое исчезает на фоне успешного лечения депрессии),
- нежелательными явлениями при приёме препаратов (антихолинергических, антигистаминных);
- нарушениями сна;
- (синдром обструктивного апноэ сна, другие диссомнии);
Ввиду «перекрытия» клинической картины УКР, вызванной различными этиологическими факторами, выявление у пациента умеренного когнитивного расстройства требует подробной клинической оценки, с целью выявления корригируемых причин состояния. Прогностическая значимость выявления синдрома УКР однозначно не определена.
В качестве факторов риска трансформации УКР в деменцию выделяются:
- атеросклероз церебральных артерий,
- гиперхолестеринемия,
- сахарный диабет,
- артериальная гипертензия,
- курение,
- метаболический синдром.
К развитию деменции приводит совокупность нескольких, часто связанных между собой, патологических процессов, включая атрофию, дегенеративные и воспалительные изменения, инсульт и генетические факторы. С учётом большого значения для развития деменции потенциально обратимых сосудистых механизмов [7], предполагается, что коррекция факторов риска у лиц в возрасте 65 лет и старше приводит в дальнейшем к снижению распространённости деменции на 50%[6].
Таким образом, при выявлении у пациентов, когнитивных нарушений, не достигающих уровня деменции в сочетании с клиническими и/или визуализационными признаками цереброваскулярного заболевания необходимо проведение полноценного обследования. Требуется выявление корригируемых факторов риска сердечно-сосудистых заболеваний (артериальная гипертензия, сахарный диабет и метаболический синдром, курение). По результатам проводится модификация образа жизни и внимательный подбор терапии, контролирующей артериальное давление, холестериновый и углеводный обмен. В настоящее время не выявлено методов лечения, улучшающих исходы УКР. На основании результатов исследований, проведённых к настоящему времени, назначение антихолинэстеразных препаратов на стадии УКР не рекомендуется (уровень доказательности 1В) [10]
III стадия (тяжёлая)
Выраженные когнитивные нарушения(эвфемизм, который используется отечественными неврологами для обозначения деменции). Когнитивные нарушения достигают степени умеренной или тяжелой деменции и сопровождаются грубыми аффективными и поведенческими нарушениями (грубым снижением критики, апатико-абулическим синдромом, расторможенностью, вспыльчивостью). Развиваются грубые нарушения ходьбы и постурального равновесия с частыми падениями, выраженные мозжечковые расстройства, тяжелый паркинсонизм, недержание мочи.
Как правило, отмечается сочетание нескольких основных синдромов. Нарушается социальная адаптация, больные постепенно утрачивают способность обслуживать себя и нуждаются в постороннем уходе. При деменции отмечаются когнитивные нарушения в нескольких сферах с затруднениями в профессиональной деятельности и повседневной активности. Пациенты с лёгкой деменцией могут сохранять навыки самообслуживания, затрудняясь только при выполнении сложных задач, особенно, если требуется обрести новые навыки. В отличии от деменции при болезни Альцгеймера (БА), для определения сосудистой деменции (СД) не было создано единых критериев диагностики. Существует несколько подходов, которые плохо валидизированы, и не согласуются между собой.
СД является вторым по распространённости типом деменции после БА. Данные о частоте встречаемости отличаются ввиду отсутствия общепринятых критериев диагностики состояния, доля таких пациентов среди больных с деменцией составляет 10-33% [35]. У лиц старше 65 лет данное состояние встречается с частотой 1,2 — 4,2% [16]. Деменция, связанная с ДЭП составляет, по-видимому, до 70-80% случаев СД, остальные случаи связаны с постинсультной деменцией. Особенностями этого вида деменции являются:
- постепенное развитие, часто со ступенчатым прогрессированием,
- раннее нарушение регуляторных функций,
- развитие аффективных нарушений (депрессии и апатии) с относительной сохранностью личности (возможно обострение личностных черт),
- сочетание с двигательными нарушениями — подкорково-лобной дисбазией, постуральной неустойчивостью, реже с паркинсонизмом;
- развитие псевдобульбарного синдрома с дизартрией и рефлексами орального автоматизма,
- признаки пирамидной недостаточности (патологические стопные и кистевые рефлексы, патологическое расширение рефлексогенных зон на конечностях)
Двигательные нарушения
Хотя пирамидные знаки (оживление сухожильных рефлексов, анизорефлексия) встречаются у больных ДЭП довольно часто, если у больного отсутствуют эпизоды инсультов с острым развитием пирамидных нарушений, парезы и спастичность наблюдаются сравнительно редко. Постепенное развитие спастического пареза у больного с предполагаемой ДЭП требует исключения иного заболевания (спондилогенная шейная миелопатия, опухоли и т.д.). Тем не менее подострое (в течение нескольких недель) развитие гемипареза может быть связано с развитием стеноза или тромбоза внутренней сонной артерии (так называемый медленный инсульт). Мозжечковые и экстрапирамидные нарушения встречаются в структуре клинических проявлений ДЭП нечасто. Гораздо чаще двигательные возможности пациента ограничиваются нарушениями ходьбы и равновесия, которые могут иметь комбинированный генез. Они бывают следствием поражения пирамидных, экстрапирамидных, мозжечковых систем, но нередко носят первичный характер и отражают нарушения функционирования сложных систем двигательного контроля, замыкающихся через лобную кору и включающих ее связи с подкорковыми и стволовыми структурами. Первичные нарушения ходьбы и равновесия, в зависимости от локализации и обширности поражения, могут быть представлены подкорковой (лобно-подкорковой) дисбазией, подкорковой или лобной астазией. Именно сложные нарушения двигательного контроля наряду с псевдобульбарным синдромом и тазовыми нарушениями лучше всего коррелируют с выраженностью когнитивных нарушений [2].
ЛЕЧЕНИЕ
Коррекция факторов риска сосудистых осложнений
По причине большой значимости повторных инсультов для прогрессирования как когнитивных, так и двигательных нарушений у пациентов с ДЭП, профилактика сосудистых осложнений рассматривается как более приоритетная задача, чем коррекция уже имеющих симптомов. Указывается на необходимость "агрессивной" профилактики у таких пациентов.
Антигипертензивная терапия
Доказано, что снижение артериального давления уменьшает риск развития деменции и снижает скорость прогрессирования когнитивных нарушений. По результатам мета-анализа исследований Syst-Eur (нитрендипин против плацебо), PROGRESS (индапамид и периндоприл против монотерапии индапамидом и плацебо), SHEP, and HYVET-Cog (индапамид и периндоприл против плацебо) было показано, что снижение артериального давления обеспечивает снижение относительного риска деменции до 0,87 (95% CI: 0.76-1.00) [31]. На практике снижение артериального давления рекомендуется только пациентам с артериальной гипертонией. При этом у пациентов с признаками цереброваскулярного заболевания снижение давления может нарушать перфузию головного мозга, что отрицательно влияет на состояние пациентов, повышает риск нарушений мозгового кровообращения. Доказательных данных об оптимальном режиме антигипертензивной терапии в этой группе пациентов не получено [5].
Коррекция нарушений углеводного обмена
На сегодня не вызывает сомнений существование причинно-следственной связи между нарушениями углеводного обмена и высоким риском развития расстройств мозгового кровообращения, в том числе дисциркуляторной энцефалопатии и сосудистой деменции. Активно обсуждается проблема связи между СД 2 типа и риском развития других типов деменции, в частности болезни Альцгеймера. Адекватный контроль гликемии рекомендуется для профилактики осложнений сахарного диабета. Влияние степени компенсации углеводного обмена на выраженность когнитивных нарушений изучено в небольших исследованиях. Была показана связь концентрации гликозилированного гемоглобина и колебаний уровней глюкозы с выраженностью когнитивных нарушений у пациентов с ДЭ.
Эффективность сочетания лекарственных и немедикаментозных методов лечения была подтверждена в клинических условиях. Так, у пожилых пациентов с СД 2 типа, не имеющих проявлений деменции, адекватная коррекция углеводного обмена (соответствующая диета и систематический прием сахароснижающих препаратов) позволила добиться снижения риска развития когнитивных нарушений более чем в 2 раза. В результате эффективного контроля гликемии уменьшение концентрации гликированного гемоглобина на 1% сопровождается снижением риска микрососудистых осложнений на 25%. К сожалению, адекватная коррекция метаболических нарушений у больных с СД 2 типа не всегда бывает возможна. По данным исследований последних лет лишь 1/3 больных придерживаются врачебных рекомендаций, по контролю основных факторов риска сердечно-сосудистых осложнений: уровня АД, содержание липидов и гликозилированного гемоглобина в крови.
В то же время коррекция углеводного обмена сама по себе не всегда способна полностью устранить имеющиеся в организме изменения, обусловленные СД 2 типа, и надежно предупредить развитие цереброваскулярных заболеваний, особенно у больных, имеющих дополнительные факторы риска сердечно-сосудистых заболеваний. Высокая вероятность развития повторных эпизодов острой церебральной ишемии сохраняется у больных, перенесших мозговой инсульт, обусловленный поражением сонных артерий. Даже снижение уровня глюкозы в крови не устраняет риск развития повторного ишемического инсульта.
Гиполипидемическая терапия. Статины
В рандомизированных клинических исследованиях не было доказано, что снижение уровня холестерина у пациентов, принимающих статины снижает частоту развития когнитивных нарушений или деменции. Эта группа препаратов является неотъемлемой частью схем для первичной и вторичной профилактики инсультов у пациентов с лабораторными и/или инструментальными данным в пользу атеросклероза брахиоцефальных артерий и магистральных артерий головы, конечностей и коронарных артерий.
Но, поскольку в настоящее время общепринята липидная теория атеросклероза, исследование уровня холестерина крови и соотношения его фракций, содержащихся в атерогенных липопротеидах низкой плотности (ЛПНП) и антиатерогенных липопротеидах высокой плотности (ЛПВП), имеет большое значение для профилактики прогрессирования атеросклероза. Роль дислипидемии в развитии инсульта менее изучена, чем в работах, посвященных развитию инфаркта миокарда. По результатам Мусиной Н.П., Драпкиной О.М., то или иное нарушение липидного обмена (включая гиперхолестеринемию, гипертирглицеридемию, снижение холестерина ЛВП), наблюдается у 85 % пациентов, перенесших ишемический инсульт. Авторы признают, что показатели липидного спектра, так же как и уровень АД, у больных, перенесших инсульт, не достаточно хорошо контролируются. Согласно их данным целевые цифры липидного спектра достигаются лишь у 4,5 % данных пациентов. В этой связи необходим поиск путей, повышающих приверженность больных к контролю липидного спектра и мотивацию врачей на достижение целевых параметров липидов крови у пациентов, перенесших инсульт. В плане терапии должно быть предусмотрено снижение уровня липидов крови с использованием статинов до целевых цифр (уровень общего холестерина менее 4,0 ммоль/л, холестерина ЛПНП менее 2,5 ммоль/л, триглицеридов менее 150 мг/дл), а также повышение уровня холестерина ЛПВП (более 1,2 ммоль/л). У пациентов со спонтанными кровоизлияниями нет чётких представлений о целесообразности использования статинов. Несмотря на то, что в большом количестве исследований показана обратная зависимость между концентрацией холестерина ЛПНП (β-липопротеидов) и риском развития внутримозгового кровоизлияния [25], по данным мета-анализов не было установлено, что лечение статинами повышает риск первичного развития кровоизлияний и оказывает влияние на прогноз [15]. Принимая во внимание, эти факты, нужно более внимательно относится к показателям липидного обмена у пациентов с факторами риска ВМК. Во всех случаях, решение о назначении терапии должно учитывать ожидаемую продолжительность жизни, рассматривая набор сопутствующих заболеваний.
Антитромботическая терапия
В отношении этой группы препаратов показана эффективность для первичной и вторичной профилактики инсульта. Исследований использования аспирина и других антитромбоцитарных препаратов для профилактики и лечения ДЭ не проводилось [45].
Снижение уровня гомоцистеина
Повышенный уровень гомоцистеина рассматривается как фактор риска сосудистых заболеваний и может сочетаться с повышенным риском развития деменции [13] В рандомизированном контролируемом клиническом исследовании с участием 185 пациентов в возрасте старше 65 лет, страдающих цереброваскулярным заболеванием, изучалась коррекция уровня гомоцистеина с назначением препаратов фолиевой кислоты, витаминов В12, В6 и В2 [36]. Через год лечения отмечалось снижение уровня гомоцистеина, при этом улучшения когнитивных функций не отмечалось.
Здоровый образ жизни и упражнения по развитию памяти
Увеличивается количество данных о том, что модифицируемые отдельные факторы риска, связанные с образом жизни (курение, употребление алкоголя, физическая активность и диета) оказывают влияние на когнитивные функции в конце жизни, что указывает на важность здорового образа жизни в любом возрасте [34]. По данным обсервационных исследований активный отдых обеспечивал снижение риска сосудистых когнитивных нарушений, развития сосудистой и смешанной деменции [39] По данным мета-анализа исследований, низкий уровень образования сочетался с более высоким риском развития деменции (БА, сосудистой и неуточнённой деменции) с относительным риском 2.61 (95%CI 2.21–3.07) для исследований с оценкой распространенности и 1.88 (95%CI 1.51–2.34) для исследований с оценкой частоты развития деменции. Утверждена актуальность концепции «когнитивного резерва», согласно которой высокий уровень образования значительно снижает риск развития деменции различной этиологии. Однако, образование не оказывает влияния на возраст развития деменции. После развития когнитивных нарушений у лиц с высшим образованием, они быстро прогрессируют. Образование также не влияет на возраст смерти у лиц с деменцией [22].
Противодементные препараты
В настоящее время для уменьшения выраженности основных симптомов при деменции используются препараты, улучшающие передачу сигналов между нейронами через синапсы и предохраняющие нейроны от гибели: ингибиторы ацетилхолинэстеразы и антагонисты глутаматных NMDA–рецепторов. В рандомизированных клинических исследованиях получены предварительные положительные данные об использовании донепезила (Арисепт, Алзепил) [20] и галантамина (Галантамин, Нивалин, Реминил) [4] у пациентов с СД. Все перечисленные препараты обеспечивают снижение выраженности основных когнитивных (проблемы памяти, речи, внимания) и поведенческих нарушений (возбуждение, агрессивность). По данным мета-анализа шести исследований антихолинэстеразных препаратов было показано отсутствие влияния на исход при сосудистых когнитивных нарушениях, несмотря на отдельные положительные данные. Авторы обзора пришли к выводу, что эффект от назначения антихолинэстеразных препаратов имеет неопределённую клиническую значимость [17]. Эффективность мемантина в дозе 20 мг/сут у пациентов с сосудистой деменцией умеренной и тяжёлой степени оценивалась в двух кратковременных (28 недель) исследованиях [20]. Несмотря на положительное влияние препарата на оценки когнитивных нарушений с использованием шкал, не было отмечено изменений в общем клиническом состоянии и повседневной активности у пациентов. Мемантин был безопасен и хорошо переносился пациентами. Поскольку терапевтическая направленность мемантина и ингибиторов ацетилхолинэстеразы различна, они могут назначаться одновременно (клинические испытания в США показали эффективность такого сочетания). Нет данных в пользу какого-либо из противодементных препаратов, как при БА, так и при СД.
Важно понимать, что в большинстве случаев прием антидементных препаратов не обеспечивает улучшения состояния больного. Он лишь существенно замедляет темпы ухудшения симптоматики. Поэтому через 1–2 года после начала терапии в связи с прогрессом деменции симптомы продолжат усиливаться, хотя темпы прогрессирования заболевания могут быть ниже, чем при отсутствии медикаментозного лечения.
На практике мемантин и антихолинэстеразные препараты активно используются в лечении больных СД, в связи отсутствием других видов лечения с доказанной эффективностью. Назначение противодементных препаратов оправдано и сложностью дифференциальной диагностики СД и болезни Альцгеймера в отдельных случаях, а также частым их сочетанием. Ввиду отсутствия доказательных данных как при сосудистом, так и при дегенеративном поражении головного мозга, использование противодементных препаратов на стадии умеренного когнитивного расстройства не показано.
Ноотропные и вазоактивные препараты
Несмотря на многолетние отечественные традиции, использование сосудистых препаратов для лечения хронических сосудистых поражений головного мозга не оправдано. В настоящее время нет доказательств эффективности алкалоидов спорыньи (ницерголина), препаратов Гинкго билоба, метилксантинов (пентоксифиллина) для лечения когнитивных нарушений, вызванных сосудистым поражением головного мозга. Несмотря на большое количество мелких исследований, качественных доказательных данных в пользу назначения отечественных (фенотропил, фенибут) и зарубежных (пирацетам, аминалон) ноотропных препаратов при хронических сосудистых заболеваниях не получено.
Заключение
Диагноз дисциркуляторной энцефалопатии (ДЭП) устанавливается на основании жалоб, анамнеза, данных клинико-нейропсихологического обследования пациентов и нейровизуализации (предпочтительнее, МРТ головного мозга). Для исключения состояний со сходной клиникой могут потребоваться дополнительные лабораторные исследования.
Визуализационные признаки сосудистого поражения головного мозга являются обязательным, но недостаточным основанием для диагноза. У пациентов с распространёнными сосудистыми изменениями мозга может не быть симптомов заболевания или их нарушения вызываются другими, например, нейродегенеративными заболеваниями.
Набор патологических изменений у каждого пациента косвенно отражает профиль факторов риска и причин когнитивных нарушений:
- распространённый лейкоареоз — артериальная гипертония,
- крупные лакунарные инфаркты - микроатероматоз, микроэмболия,
- выраженные избирательные атрофические изменения отдельных участков мозга — нейродегенеративные заболевания).
Поскольку ДЭП — это состояние, вызванное преимущественно поражением мелких сосудов, целесообразно выделять артериосклеротический (основной визуализационный феномен - лейкоареоз) и мультиинфарктный подтипы (мелкие полные и неполные инфаркты, лакуны) дисциркуляторной энцефалопатии, в случае их сочетания — описывать выявленные сосудистые изменения вещества головного мозга. Такой подход позволяет использовать при диагностике типа ДЭП не только данные анамнеза (оценка факторов риска, без учёта того, как они реализовались у конкретного пациента), но и результаты нейровизуализации.
У пациентов с сосудистой деменцией (СД), коррекция факторов риска сосудистых заболеваний является необходимым мероприятием, снижающим риск инфарктов, инсультов и артериальных тромбозов. Если не учитывать вклад в прогрессирование заболевания сосудистых осложнений, профилактическое лечение не оказывает влияния на выраженность когнитивного снижения и темп прогрессирования деменции. Показан эффект от модификации образа жизни (отказ от курения, умеренная физическая нагрузка, активный отдых, диета) на прогрессирование когнитивных нарушений.
Отсутствуют убедительные доказательные данные о долговременной эффективности вазоактивных, ноотропных и противодементных препаратов в лечении пациентов с сосудистыми когнитивными нарушениями.
Диагноз сосудистой деменции только выставляется только пациентам с доказанным значимым сосудистым поражением мозга в отсутствии других причин развития симптомов. Актуален принцип "презумпция депрессии", согласно которому, пожилые люди с субъективными или объективными указаниями на нарушения памяти и внимания проходят скрининговое обследование на депрессию (например, GDS-15). Результаты обследования сопоставляются с набором жалоб и данными о поведении пациента. При наличии депрессии, оценка уровня когнитивного снижения правомочна только на фоне коррекции аффективных нарушений.
Сложность дифференциальной диагностики СД и БА и частота сочетания этих состояний оправдывают назначение мемантина и антихолинэстеразных препаратов (донепезила, ривастигмина и галантамина), в случаях без уверенности в отношении диагноза одного из этих состояний. Препараты оказывают статистически значимое влияние на прогрессирование когнитивного дефицита при БА. В отношении сосудистых когнитивных нарушений были получены менее убедительные доказательные данные, распространяющиеся только на кратковременый приём препаратов.
Отличить сосудистый паркинсонизм от отдельных случаев болезни Паркинсона (преобладание акинетико-ригидного синдрома, отсутствие типичного тремора, отсутствие выраженных вегетативных нарушений) можно только на основании патогистологического исследования головного мозга. Достоверных клинических и нейровизуализационных критериев этих состояний нет. У больных болезнью Паркинсона могут выявляться последствия перенесённых инсультов и хронические сосудистые изменения различной выраженности.
Поскольку у части пациентов с сосудистым паркинсонизмом лечение противопаркинсоническими препаратами может быть эффективным, при наличии экстрапирамидных симптомов: гипокинезия, ригидность и нарушения ходьбы, целесообразно пробное назначение леводопы 200-250мг по 1⁄2 таблетки х 3 раза в день до 2-х месяцев. При развитии клинического эффекта, возможна длительная терапия с повышением дозы. При отсутствии — отмена препаратов.
Сомнительна польза от назначения антидепрессантов, противодементных и противопаркинсонических препаратов пациентам, которые не смогут продолжать приём достаточное время в условиях адекватного медицинского наблюдения. Сэкономленные деньги могут пойти на улучшение условий жизни пожилого человека (отдых, покупка более качественной еды и удобной одежды).


