Паркинсонизм
Владение вопросами диагностики и лечения экстрапирамидных заболеваний считаю "лакмусовой бумажкой" для оценки уровня невролога. Набор симптомов от начала до поздних стадий заболевания может кардинально поменяться. Мультисистемность, характерная для большинства экстрапидамидных заболеваний, требует для врача одинаково глубоких знаний в и терапии и психиатрии. В большой доле случаев, известное к настоящему времени лечение, наносит пациенту больше вреда, чем пользы. Ввиду этого, актуальные немедикаментозные меры.
Работа с пациентом, который не выздоравливает, а также с членами его семьи, составляет серьёзную психологическую проблему.
Однако, к чему сдаваться? Чаще, всё же основные трудности и осложнения, связаны распространёнными болезнями: инфарктами, инсультами, онкологическими заболеваниями. Качественная работа невролога позволит пациенту закончить жизненный путь с паркинсонизмом, а не от него.
Алгоритмы лечения моторных симптомов болезни Паркинсона
перевод обзора Algorithms for the treatment of motor problems in Parkinson’s disease
E. Dietrichs, P.Odin2
Аннотация
Для медикаментозного лечения моторных симптомов болезни Паркинсона было разработано несколько стратегий. Доступен ряд руководств и обзоров доказательных данных, однако, нет ни документов, ни соглашений в пользу превосходства того или иного подхода. В этом обзоре приводится два алгоритма, которые могут помочь в выборе лечения для больного болезнью Паркинсона на различных стадиях заболевания.
Первый алгоритм содержит подходы к лечению БП при первичном обращении по поводу моторных симптомов заболевания. Он создан преимущественно на основании рекомендаций по лечению скандинавских стран и Германии.
Во втором алгоритме содержатся данные, помогающие сделать выбор в отношении различных инструментальных подходов к лечению распространённых стадий БП.
К настоящему времени не получено достаточного количества данных сравнительных исследований, для того, чтобы рекомендовать один из видов лечения, как на ранних стадиях БП, так и на распространённых, при которых развиваются моторные осложнения. Каждый пациент требует индивидуализированного лечения. Алгоритмы лишь указывают существующие возможности для принятия решений.
1 | ВВЕДЕНИЕ
Болезнь Паркинсона (БП) - нейродегенеративное заболевание, которое вызывается гибелью дофаминергических нейронов чёрного вещества, а также нейронов других ядер ствола головного мозга, отдельных областей коры больших полушарий.1 Как правило, даже на момент постановки диагноза, у пациентов встречается сочетание моторных и немоторных симптомов.2 Клинический диагноз, как правило, устанавливается на основе выявления характерных симптомов - гипокинезии/брадикинезии в сочетании с тремором покоя и/или ригидностью. Со временем, часто развиваются значимые постуральные нарушения, прежде всего нарушения ходьбы.3 Лечение дофаминергическими средствами может на время уменьшить моторные симптомы, но, уже на ранних стадиях заболевания, могут возникнуть флуктуации.4 Поэтому, большинство подходов к лечению преследуют цель - отсрочить развитие моторных флуктуаций на максимальное время. Доступны различные рекомендации и руководства по лечению, разработанные, как отдельными авторами, так и международными ассоциациями и группами специалистов.5-19 Часть из них, такие как недавно опубликованные руководства из Германии и Швеции, основаны на доказательных данных,18,19 в то время, как другие - на соглашении группы экспертов. Руководства отличаются по различным моментам, многие вопросы остаются открытыми. Например, в отношении многих подходов к лечению не получено достаточно данных сравнительных исследований, для того, чтобы на основании доказательных данных выбрать одну из альтернатив.
Этот обзор даёт одну из возможных стратегий лечения моторных симптомов БП. Он подготовлен с учётом рекомендаций по лечению из скандинавских стран (Дания,14 Норвегия,16 Швеция19) и Германия,18 при этом, отражает также личное мнение авторов. У ряда больных БП, немоторные симптомы также являются важной проблемой.20 Ряд симптомов может уменьшаться под действием стандартного лечения БП, в то время как для большого количества других требуется отдельное лечение. Мы не включили в обзор данные о лечении немоторных симптомов, поскольку вопрос в настоящее время находится в стадии разработки, и информации по нему значительно меньше.21
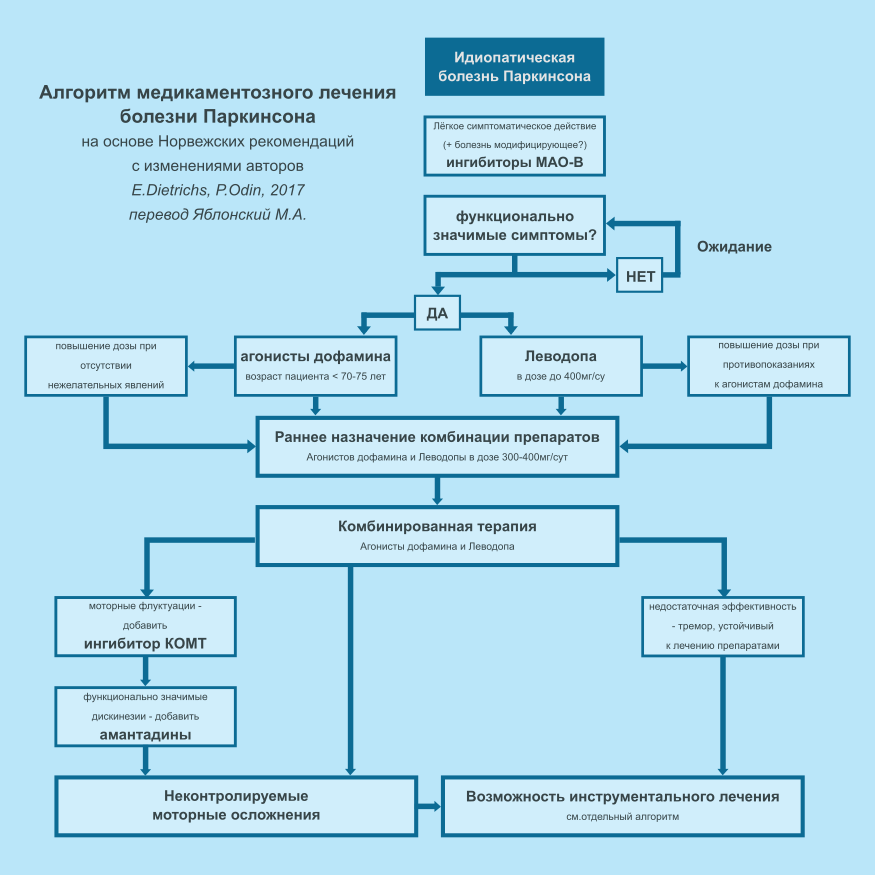
2 | СТАРТОВАЯ ТЕРАПИЯ
К сожалению, к настоящему времени не разработано эффективной нейропротективной терапии БП. В исследовании DATATOP22 было показано, что назначение селегилина позволяет отсрочить назначение препаратов леводопы на начальных стадиях БП, однако, большинство исследователей связывают этот эффект с симптоматическим действием препарата-ингибитора MAO-B, задерживающего удаление дофамина из дофаминергических синапсов. В двух длительных двойных слепых рандомизированных исследованиях, выполненных в Скандинавских странах, в которых сравнивались назначение селегилина и леводопы на начальных стадиях БП, было показано, что пациентам, получающим плацебо, необходимо в дальнейшем более значимое повышение доз леводопы, чем пациентам, которые получали селегилин.23,24 Это прогрессирующее увеличение различий между группами сложно объяснить только симптоматическим действием, и в обоих исследованиях предполагался болезнь-модифицирующий эффект, однако, их результаты не получили международного признания. Более того, результаты исследования ADAGIO, которое было двойным слепым исследованием лечения пациентов разагилином на начальных стадиях БП с отсроченным стартом, показали, что болезнь-модифицирующий эффект препарата отмечался в дозе 1 мг/сут, но не 2 мг/сут.25 Как и селегилин, разагилин является ингибитором MAO-B, и оказывает симптоматическое действие у больных БП. Интерпретация результатов исследования ADAGIO остаётся противоречивой,26,27 к настоящему времени, не существует международного соглашения об использовании разагилина в качестве нейпротективного препарата. В открытом 3-х летнем исследовании ADAGIO с оценкой отдалённых результатов не удалось показать преимущества раннего начала лечения разагилином.28 Поскольку эти ингибиторы MAO-B оказывают достоверное, но незначительное симптоматическое действие, и поскольку возможность наличия у препарата болезнь-модифицирующих свойств, мы рекомендуем, при первичном установлении диагноза, начинать лечение либо с селегилина 10мг в день, либо с разагилина 1мг в день.16 Однако, у пациентов старшего возраста (старше 75 лет), назначение ингибиторов MAO-B может быть неоправданным, ввиду более короткой ожидаемой продолжительности жизни (недостаточно времени для развития положительного эффекта от незначительного влияния на прогресс заболевание) и более высокого риска нежелательных явлений. Как немецкое, так и шведское руководства рассматривают начало лечения ингибиторами MAO-B как предпочтительное в ряду других подходов к терапии впервые выявленных случаев заболевания,18,19 однако, в немецком руководстве указывается на недостаточную достоверность сведений в пользу болезнь-модифицирующего действия ингибиторов MAO-B. Авторы не рекомендуют использовать эти препараты в случаях, когда болезнь-модифицирующее действие является единственным показанием к их назначению.18
3 | СИМПТОМАТИЧЕСКОЕ ЛЕЧЕНИЕ
Дофаминергические препараты (леводопа и агонисты дофамина) являются наиболее эффективными препаратами для симптоматического лечения. У нас нет оснований полагать, что отсроченное начало приёма дофаминергических средств приносит какую-либо пользу. Поэтому, мы рекомендуем назначить эти препараты когда у пациента появятся симптомы, доставляющие ему дискомфорт.14,16,18,19 Однако, в вопросе о том, как именно должно быть начато симптоматическое лечение, определённости меньше. В немецком и шведском руководствах, основанных на доказательных данных, указывается на предпочтительность одного из трёх различных подходов к раннему симптоматическому лечению: препараты леводопы, агонисты дофамина и ингибиторы MAO-B,18,19 менее предпочтительно использование в лечении комбинации леводопы и ингибитора MAO-B.19 Несомненно, препараты леводопы являются наиболее эффективными из пероральных лекарственных форм, однако, у большинства пациентов, получающих леводопу в дозе 600мг/сут и более, с течением времени развиваются моторные флуктуации.29 У пациентов, которые получают терапию агонистами дофамина, моторные флуктуации встречаются реже, чем при монотерапии препаратами леводопы. Похоже, что осложнения развиваются более поздно, если начать лечение с агонистов дофамина, а препараты леводопы назначить дополнительно только при необходимости большего эффекта от лечения.30,31 Однако, нет исследований, в которых оценивалось бы преимущество отсроченного назначения препаратов леводопы над ранним началом комбинированного лечения агонистами дофамина и низкими дозами препаратов леводопы. Также остаётся неясным, оказывает ли начало терапии с агонистов дофамина длительное профилактической действие в отношении развития дискинезий, которое сохраняется и после дополнительного назначения леводопы. В выполненном недавно длительном открытом исследовании, было показано очень незначительное, но длительное влияние на оценки подвижности пациентов, начала лечения препаратами леводопы в сравнении с началом лечения с агонистов дофамина или ингибиторов MAO-B.32
Назначение агонистов дофамина в определённой степени ограничено их возможными побочными действиями. При приёме агонистов дофамина чаще, чем при приёме леводопы развиваются галлюцинации, сонливость и отёчность нижних конечностей,30,31 эрголиновые агонисты дофамина могут вызывать ретроперитонеальный, плевропульмонарный фиброз и фиброз клапанов сердца.33 Кроме того, продолжают поступать данные о расстройствах контроля импульсивного поведения (РКИП), например игровой зависимости (гемблинг), компульсивном половом поведении, компульсивных покупках и/или переедании. В крупном перекрёстном исследовании, Weintraub с соавт.34 выявили РКИП у 17,9% больных БП, принимающих агонисты дофамина, и лишь у 6,9% остальных пациентов. Другие исследователи сообщают, что признаки РКИП отмечаются 39% больных БП, принимающих агонисты дофамина,35 в недавнем исследовании было показано, что в сравнении с контрольной группой, у больных БП, принимающих агонисты дофамина без леводопы, отношение шансов выявления расстройств импульсивного поведения составляет 7,4; у пациентов, получающих комбинированную терапию агонистами дофамина и препаратами леводопы - 4,6; а у пациентов, которым проводилась монотерапия препаратами леводопы.1,2,36 Несмотря на то, что большинство из этих пациентов и их ухаживающих лиц не считают РКИП серьёзной проблемой, риск развития этого состояния должен приниматься во внимание в начале лечения дофаминергическими средствами. РКИП, вероятно, чаще развиваются при приёме пероральных лекарственных форм прамипексола и ропинирола, чем при лечении трансдермальной формой ротиготина.35,37
При использовании агонистов дофамина требуется определённая осторожность, однако, не менее значимым является более позднее развитие моторных осложнений, поэтому рекомендации по лечению включают показания к назначению неэрголиновых агонистов дофамина, по крайней мере более "молодым" пациентам (в возрасте <70 - 75 лет, т.е., пациентам, ожидаемая продолжительность жизни которых предполагает развитие моторных флуктуаций на фоне приёма препаратов леводопы).14,16 Поскольку леводопа является наиболее эффективным средством для симптоматического лечения, возможно, оптимальной стратегией будет комбинация неэрголиновых агонистов дофамина и леводопы в низкой дозе (до 300-400мг/сут). По данным новых шведских руководств, леводопа является единственным препаратом, наиболее предпочтительным для стартовой терапии,19 однако, в немецких рекомендациях, указывается на необходимость использовать препарат в минимальной дозе.18
Если симптоматическое лечение не даёт достаточного эффекта, рекомендуется повышать дозу, вне зависимости какой препарат был назначен в начале - агонист дофамина или леводопа. Если не достигается удовлетворительный эффект при приёме одного вида дофаминергических средств, рекомендуется лечение комбинацией леводопы и агонистов дофамина.14-16 На основании изложенного выше, выглядит целесообразным ранее начало комбинированной терапии. Алгоритм возможных подходов к лечению БП приводится на рисунке 1.
4 | ЛЕЧЕНИЕ МОТОРНЫХ ОСЛОЖНЕНИЙ
После нескольких лет лечения дофаминергическими препаратами, особенно препаратами леводопы, у многих пациентов развиваются моторные осложнения, такие как "феномен истощения эффекта однократной дозы" и дискинезии.38 В основе развития моторных флуктуаций лежат различные патофизиологические механизмы, однако, наиболее целесообразным подходом к лечению является уменьшение пульсирующего характера дофаминергической стимуляции.39 Может быть эффективным использование более частых приёмов препаратов в меньшей дозе. Ингибиторы MAO-B уменьшают скорость разрушения дофамина, а ингибиторы катехол-O-метилтрансферазы (КОМТ) уменьшают скорость метаболизма леводопы, увеличивая время полураспада препарата в плазме. Таким образом, препараты обеих групп, могут увеличивать действие препаратов леводопы, что позволяет их назначать при развитии моторных флуктуаций и феномена истощения эффекта однократной дозы. Если пациент, на момент развития моторных осложнений, уже принимает ингибитор MAO-B, рекомендуется дополнительное назначение ингибиторов КОМТ.16,19
Тяжёлые дискинезии пика дозы могут уменьшиться при снижении дозы, однако, этом существует риск недостаточного контроля симптомов и увеличения продолжительности "выключения". Альтернативным подходом к лечению могут быть амантадины. Антидискинетическое действие амантадинов хорошо известно,40,41 в связи чем, препараты этой группы рекомендуются при моторных флуктуациях и дискинезиях.14,18 Однако, эти препараты в настоящее время не доступны в ряде стран, поэтому не включены в Норвежские руководства.16
Сафинамид, ингибитор MAO-B, который имеет и другие фармакологические свойства, недавно стал рассматриваться как новая возможность лечения моторных флуктуаций на промежуточных и поздних стадиях БП.42 Сафинамид, как и другие ингибиторы MAO-B, уменьшает продолжительность периодов "выключения". У сафинамидна предполагается антидискинетическое действие, но оно доказано недостаточно убедительно. В шведском руководстве амантадин и сафинамид рассматриваются как второстепенные опции лечения, рассматривается их использование, как дополнительных средств оптимизации дофаминергической терапии, при развитии у пациентов моторных осложнений.19
Рисунок 1 Алгоритм медикаментозного лечения болезни Паркинсона
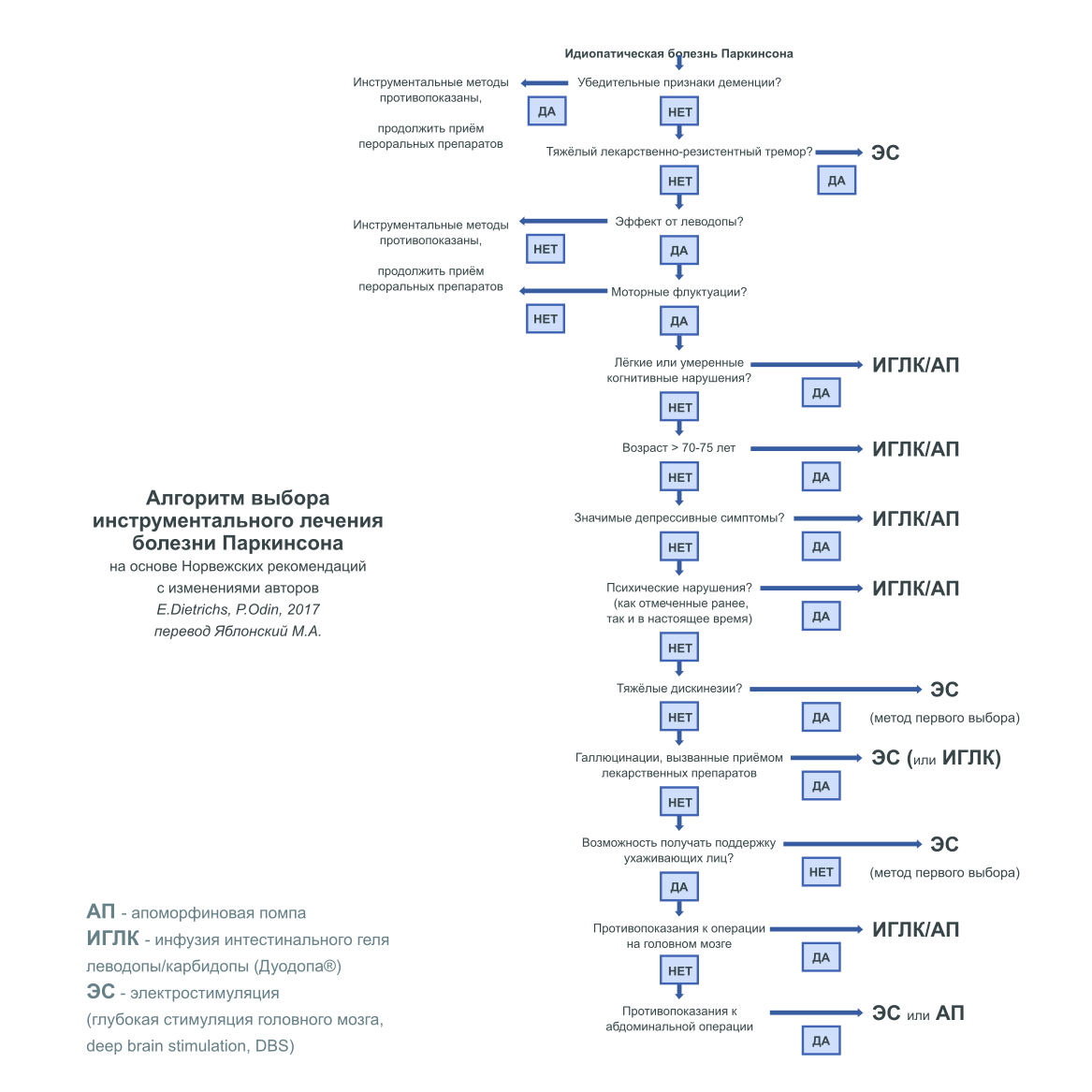
5 | ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ЛЕЧЕНИЯ
Возможность использования инструментальных методов необходимо рассматриваться, если описанные выше стратегии недостаточно контролируют моторные осложнения, или если у пациента есть моторные симптомы, которые не контролируются стандартными схемами приёма пероральных препаратов. К доступным в настоящее время инструментальным методам относятся подкожные введения апоморфина, постоянная инфузия интестинального геля леводопы-карбидопы (Дуодопа®) (ИГЛК) и глубокой электростимуляции головного мозга (ЭС). Кроме того, в качестве метода лечения "по требованию" могут рассматриваться подкожные инъекции апоморфина во время тяжёлых периодов "выключения".18,19
ЭС, по данным немецких и шведских руководств, хорошо изученный приоритетный метод лечения.18,19 ЭС безопасна и эффективна, её свойства сохраняются в течение длительного времени.43-46 В большинстве центров основной мишенью лечебных воздействий при БП является субталамическое ядро (СТЯ). ЭС СТЯ может уменьшить основные моторные симптомы БП, а также моторные флуктуации и дискинезии.47 В одном из исследований было установлено, что ЭС внутреннего сегмента бледного шара (БШв) обладает сходной эффективностью,48 однако, эффект от ЭС СТЯ описанный в этом исследовании, был значительно хуже, чем обычно.47,49 В другом, выполненном недавно, рандомизированном исследовании, было показано, что моторные симптомы и функции улучшаются в большей степени после ЭС СТЯ, чем ЭС БШв, при этом, воздействие на эти мишени не отличается между собой по психиатрическим и социальным последствиям.50,51 Нежелательные явления могут быть связаны с хирургическим вмешательством, имплантированными электродами или процедурой стимуляции.47 Наиболее частыми являются инфекционные осложнения, которые, по нашим данным, полученным в Осло, отмечаются в 5,6% случаев .52 У многих из этих пациентов, отдельные части имплантированных системы было необходимо на время удалить и прекратить процедуру на несколько месяцев, на время лечения инфекции. Однако, тяжёлые нежелательные явления редки, по нашим данным 3-х летняя выживаемость составляет 97%.53 По данным различных исследований, симптомные внутримозговые гематомы в пре- или послеоперационном периодах отмечаются у 0%-1.3% пациентов. К менее тяжёлым нежелательным последствиям относятся нарушения ходьбы и равновесия, которые отмечены у 8,2%-13,7% пациентов-участников рандомизированных исследований, и дизартрия - у 5,8%-10,3%.54
Особого внимания требуют нейропсихиатрические и когнитивные нарушения после вмешательств. Особенно, более высокая частота суицидальных мыслей и суицидов была отмечена после проведения ЭС, при этом однозначного взгляда на вопрос не выработано.55,56 Накопленные данные указывают на повышение оценок депрессии и гипомании, однако, степень выраженности нарушений различна.54,57 Что касается когнитивных нарушений, в выполненном недавно мета-анализе контролируемых исследований, установлено, что ЭС СТЯ является относительно безопасным вмешательством, однако, может вызывать когнитивные расстройства с преимущественным нарушением исполнительных функций и речевой активности.58 При подробном нейропсихологическом тестировании, мы выявили, что ЭС СТЯ может приводить к лёгким личностным расстройствам, повышенной импульсивности.59
Инфузия интестинального геля леводопы-карбидопы является безопасным и хорошо изученным методом, обеспечивающим длительный контроль двигательных симптомов БП и снижение риска моторных флуктуаций.60-64 Большая часть нежелательных явлений связана с использованием устройства. У большинства пациентов может отмечаться усиление дискинезий,64 однако, для контроля серьёзных осложнений, может быть использована оптимизация режима инфузии интестинального геля.65 Данные, полученные в 4-х проспективных исследованиях, недавно были включены в оценку безопасности инфузии интестинального геля с медианой продолжительности лечения - 911 дней.66 Наиболее частые нежелательные явлениями, связанными с вмешательством/использованными устройствами, были осложнения установки устройства и боль в животе, которые у 17% пациентов оценивались как серьёзные. Большинство случаев развития нежелательных явлений, не связанных с вмешательством/использованными устройствами, были типичными для лечения леводопой пожилых. У ряда пациентов было отмечено развитие острой или подострой полиневропатии.63,67 Нежелательные явления привели к прекращению лечения у 17% пациентов, чаще всего это были осложнения установки устройства. Авторы установили, что у пациентов на поздних стадиях болезни Паркинсона, инфузия интестинального геля леводопы-карбидопы обладает высокой эффективностью и относительно низкой частотой отказов от лечения.66
Апоморфиновая помпа (АП) является менее изученным инструментальным методом лечения, при этом, он менее инвазивен. Данные длительного наблюдения малочисленные, однако создаётся впечатление, что частота прекращения лечения выше чем при использовании других подходов к лечению поздних стадий болезни.68 Однако, этот метод является безопасным и эффективным у пациентов с тяжёлыми осложнениями,69-71 он уменьшает длительность периодов "выключения", улучшая течение дискинезий. Среди наиболее часто встречающихся нежелательных явлений - кожные осложнения в месте введения, наряду с общими всех для дофаминергических препаратов, такими, как нейропсихиатрические изменения, сомноленция и ортостатическая гипотензия. Данные 6-ти месячных наблюдений за лечением, полученные в недавнем проспективном исследовании, указывают на значимое повышение качества жизни, связанное со здоровьем, однако, лечение апоморфином продолжали только 100 из 142 пациентов.72 Также, в последнем, проспективном исследовании длительной эффективности, было показано, что постоянная инфузия апоморфина оказывала положительный эффект на моторные флуктуации и дискинезии, однако, три четверти пациентов прекратили лечение в течение первых 4-х лет, основной причиной отказа от лечения было уменьшение эффективности.73
Рисунок 2 Алгоритм выбора инструментального лечения болезни Паркинсона
6 | ВЫБОР ЛЕЧЕНИЯ НА ПОЗДНИХ СТАДИЯХ ЗАБОЛЕВАНИЯ
Попытки сравнить два различных подхода к лечению предпринимались в нескольких обсервационных исследования.68,74 Однако, мы не располагаем данными прямого сравнения, указывающими на преимущество одного из видов инструментального лечения. Был опубликован обзор доказательных данных, однако, в нём приводятся только рекомендации в отношении пациентов-кандидатов для инструментальных видов лечения, эти сведения могут в какой-то степени помочь выбрать лечение для отдельного пациента.75 Возможности могут быть ограничены как показаниями, так и противопоказаниями. Также необходимо принимать во внимание при выборе инструментального подхода к лечению, что немоторные симптомы для отдельных пациентов могут быть наиболее значимыми. Однако, на основании данных нескольких исследований, в которых оценивалась значимость немоторных симптомов, эти симптомы не должны быть единственным основанием для выбора лечения.75
Хороший клинический ответ на препараты леводопы является необходимым требованием для всех видов лечения. Исключение составляют пациенты с лекарственно-резистентным тремором, которые могут показать хороший ответ на ЭС. Возраст пациентов >70-75 лет является относительным противопоказанием, в то время как, когнитивные и психические нарушения (как отмеченные ранее, так и в настоящее время) являются абсолютными противопоказаниями к ЭС, ввиду риска ухудшения состояния пациента. Сосудистые и другие распространённые поражения головного мозга также могут быть противопоказаниями к оперативному лечению. Возможно использование ИГЛК и АП у пациентов с умеренными когнитивными нарушениями, однако тяжёлая деменция рассматривается как противопоказание ко всем видам инструментального лечения. Пациентам, получающим лечение при помощи насосных устройств, также требуется постоянная социальная помощь, отсутствие возможности такой помощи может быть относительным противопоказанием для этих подходов к лечению. Нейропсихиатрические нежелательные явления при терапии, могут быть противопоказанием к лечению апоморфином, в то время как заболевания тонкой кишки - противопоказанием к хирургической операции для установки устройства подачи интестинального геля леводопы-карбидопы. Недавно был опубликован более детальный обзор частых вопросов и противопоказаний, связанных с инструментальными методами лечения.54
Доказательных данных в пользу какого-либо из методов не получено.7-12,75 Поэтому, в лечении каждого пациента важен индивидуальный подход. Особое внимание следует уделить тому, какая группа симптомов - моторные или немоторные - наиболее значима для пациента на данной стадии заболевания. Алгоритмы, которые приводятся здесь, предназначены лишь для поддержки в выборе, обозначая лишь один из методов принятия решения в лечении моторных симптомов, потому, их использование требует особого внимания.
Также необходимо помнить, что лекарственные препараты лишь часть лечения БП. Дополнительное значение могут иметь информирование пациентов, социальная и организационная помощь, физические упражнения и тренировка равновесия. Наряду с этим, рекомендуется мультидисциплинарный подход,19 при котором с пациентом работают специалисты нескольких направлений, члены семьи и другие ухаживающие лица. Основной целью является выработка оптимальных индивидуальных рекомендаций. У таких пациентов необходимо рассмотреть возможности реабилитации на основе мультидисциплинарного подхода.19
Список литературы
1. Ferrer I, Martinez A, Blanco R, Dalfo E, Carmona M. Neuropathology of sporadic Parkinson disease before the appearance of parkinsonism: preclinical Parkinson disease. J Neural Transm. 2011;118:821-839.
2. Muller B, Larsen JP, Wentzel-Larsen T, Skeie GO, Tysnes OB; Parkwest Study Group. Autonomic and sensory symptoms and signs in incident, untreated Parkinson's disease: frequent but mild. Mov Disord. 2011;26:65-72.
3. Ellis TD, Cavanaugh JT, Earhart GM, et al. Identifying clinical measures that most accurately reflect the progression of disability in Parkinson disease. Parkinsonism Relat Disord. 2016;25:65-71.
4. Stocchi F, Jenner P, Obeso JA. When do levodopa motor fluctuations first appear in Parkinson's disease? Eur Neurol. 2010;63:257-266.
5. Olanow CW, Watts RL, Koller WC. An algorithm (decision tree) for the management of Parkinson's disease (2001): treatment guidelines. Neurology. 2001;56(11 Suppl 5):S1-S88.
6. Miyasaki JM, Martin W, Suchowersky O, Weiner WJ, Lang AE. Practice parameter: initiation of treatment for Parkinson's disease: an evidence-based review. Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2002;58:11-17.
7. Pahwa R, Factor SA, Lyons KE, et al. Practice parameter: treatment of Parkinson disease with motor fluctuations and dyskinesia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006;66:983-995.
8. National Collaborating Centre for Chronic Conditions (UK). Parkinson's Disease: National Clinical Guideline for Diagnosis and Management in Primary and Secondary Care. London: Royal College of Physicians (UK); 2006.
9. Oertel WH, Berardelli A, Bloem BR, et al. Chapter 14: early (uncomplicated) Parkinson's disease. In: Gilhus NE, Barnes MR, Brainin M, eds. European Handbook of Neurological Management: Vol 1. 2nd edition. Chichester: Blackwell; 2010:217-236.
10. Oertel WH, Berardelli A, Bloem BR, et al. Chapter 15: late (complicated) Parkinson's disease. In: Gilhus NE, Barnes MR, Brainin M, eds. European Handbook of Neurological Management. Vol 1, 2nd edition. Chichester: Blackwell; 2010:237-267.
11. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson's disease. Eur J Neurol. 2013;20:5-15.
12. Connolly BS, Lang AE. Pharmacological treatment of Parkinson disease: a review. JAMA. 2014;311:1670-1683.
13. Grimes D, Gordon J, Snelgrove B, et al. Canadian Neurological Sciences Federation. Canadian guidelines on Parkinson's disease. Can J Neurol Sci. 2012;39(4 Suppl 4):S1-S30.
14. DANMODIS. Parkinsons sygdom. Klinisk vejledning. 2nd Edition, 2011. http://neuro.dk/wordpress/wp-content/uploads/2012/09/Parkinsons_sygdom_Klinisk_Vejledning_2011.pdf. Accessed
December 7, 2016.
15. SWEMODIS. Svenska riktlinjer for utredning och behandling av Parkinsons sjukdom. 7th Edition, 2014. http://www.swemodis.se/ images/Dokument/Terapird%20Parkinsons%20sjukdom%20ver- sion%207%202014.pdf. Accessed December 7 2016.
16. Referansegruppen for Nasjonal kompetansetjeneste for bevegelses- forstyrrelser. Revidert terapianbefaling ved Parkinsons sykdom. 6th Edition, 2014. https://helse-stavanger.no/seksjon/NKB/Documents/ Nyhetsbulletin/Nyhetsbulletin%202014%20-%20nr.%202.pdf. Accessed December 7, 2016.
17. Reichmann H. Modern treatment in Parkinson's disease, a personal approach. J Neural Transm. 2016;123:73-80.
18. Deutsche Gesellschaft fur Neurologie. Idiopathisches Parkinson- Syndrom.Leitlinienfur Diagnostik undTherapiein der Neurologie. 2016. www.dgn.org/images/red_leitlinien/LL_2016/PDFs_Download/ 030010_LL_langfassung_ips_2016.pdf. Accessed October 17, 2016.
19. Socialstyrelsen. Nationella riktlinjer for vard vid multipel skleros
och Parkinsons sjukdom. Stod for styrning och ledning. Stockholm, 2016. http://www.socialstyrelsen.se/Lists/Artikelkatalog/
Attachments/20392/2016-12-1.pdf. Accessed December 6, 2016.
20. Chaudhuri KR, Odin P, Antonini A, Martinez-Martin P. Parkinson's disease: the non-motor issues. Parkinsonism Relat Disord. 2011;17:717-723.
21. Schrag A, Sauerbier A, Chaudhuri KR. New clinical trials for nonmotor manifestations of Parkinson's disease. Mov Disord. 2015;30:1490-1504.
22. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson's disease. N Engl J Med. 1993;328:176-183.
23. Larsen JP, Boas J, Erdal JE. Does selegiline modify the progression of early Parkinson's disease? Results from a five-year study. The Norwegian-Danish Study Group. Eur J Neurol. 1999;6:539-547.
24. Palhagen S, Heinonen E, Hagglund J, Kaugesaar T, Maki-Ikola O, Palm R; Swedish Parkinson Study Group. Selegiline slows the progression of the symptoms of Parkinson disease. Neurology. 2006;66:1200-1206.
25. Olanow CW, Rascol O, Hauser R, et al. A double-blind, delayed- start trial of rasagiline in Parkinson's disease. N Engl J Med. 2009;361:1268-1278.
26. Ahlskog JE, Uitti RJ. Rasagiline, Parkinson neuroprotection, and delayed- start trials: still no satisfaction? Neurology. 2010;74:1143-1148.
27. Clarke CE, Patel S, Ives N, Rick C, Wheatley K, Gray R. Should treatment for Parkinson's disease start immediately on diagnosis or delayed until functional disability develops? Mov Disord. 2011;26:1187-1193.
28. Rascol O, Hauser RA, Stocchi F, et al. Long-term effects of rasagaline and the natural history of treated Parkinson's disease. Mov Disord. 2016;31:1489-1496.
29. Fahn S, Oakes D, Shoulson I, et al. Levodopa and the progression of Parkinson's disease. N Engl J Med. 2004;351:2498-2508.
30. Rascol O, Brooks DJ, Korczyn AD, De Deyn PP, Clarke CE, Lang AE. A five-year study of the incidence of dyskinesia in patients with early Parkinson's disease who were treated with ropinirole or levodopa. N Engl J Med. 2000;342:1484-1491.
31. Holloway RG, Shoulson I, Fahn S, et al. Pramipexole vs levodopa as initial treatment for Parkinson disease: a 4-year randomized controlled trial. Arch Neurol. 2004;61:1044-1053.
32. PD Med Collaborative Group, Gray R, Ives N, et al. Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson's disease (PD MED): a large, open-label, pragmatic randomised trial. Lancet. 2014;384:1196-1205.
33. Antonini A, Poewe W. Fibrotic heart-valve reactions to dopamine- agonist treatment in Parkinson's disease. Lancet Neurol. 2007;6:826-829.
34. Weintraub D, Koester J, Potenza MN, et al. Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients. Arch Neurol. 2010;67:589-595.
35. Garcia-Ruiz PJ, Martinez Castrillo JC, Alonso-Canovas A, et al. Impulse control disorder in patients with Parkinson's disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014;85:840-844.
36. Erga AH, Alves G, Larsen JP, Tysnes OB, Pedersen KF. Impulsive and compulsive behaviors in Parkinson disease: the Norwegian ParkWest Study. J Parkinsons Dis. 2016. doi: 10.3233/JPD-160977.[Epub ahead of print].
37. Rizos A, Sauerbier A, Antonini A, et al. A European multicentre survey of impulse control behaviours in Parkinson's disease patients treated with short- and long-acting dopamine agonists. Eur J Neurol. 2016;23:1255-1261.
38. Olanow CW, Stern MB, Sethi K. The scientific and clinical basis for the treatment of Parkinson disease (2009). Neurology. 2009;72(21 Suppl 4):S1-S136.
39. Chaudhuri KR, Rizos A, Sethi KD. Motor and nonmotor complications in Parkinson's disease: an argument for continuous drug delivery? J Neural Transm. 2013;120:1305-1320.
40. Sawada H, Oeda T, Kuno S, et al. Amantadine for dyskinesias in Parkinson's disease: a randomized controlled trial. PLoS One. 2010;5:e15298.
41. Ory-Magne F, Corvol JC, Azulay JP, et al. Withdrawing amantadine in dyskinetic patients with Parkinson disease: the AMANDYSK trial. Neurology. 2014;82:300-307.
42. Fabbri M, Rosa MM, Abreu D, Ferreira JJ. Clinical pharmacology review of safinamide for the treatment of Parkinson's disease. Neurodegener Dis Manag. 2015;5:481-496.
43. Deuschl G, Schade-Brittinger C, Krack P, et al. A randomized trial of deep-brain stimulation for Parkinson's disease. N Engl J Med. 2006;355:896-908.
44. Krack P, Batir A, Van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson's disease. N Engl J Med. 2003;349:1925-1934.
45. Schupbach WM, Chastan N, Welter ML, et al. Stimulation of the subthalamic nucleus in Parkinson's disease: a 5 year follow up. J Neurol Neurosurg Psychiatry. 2005;76:1640-1644.
46. Schuepbach WM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson's disease with early motor complications. N Engl J Med. 2013;368:610-622.
47. Kleiner-Fisman G, Herzog J, Fisman DN, et al. Subthalamic nucleus deep brain stimulation: summary and meta-analysis of outcomes. Mov Disord. 2006;21(Suppl 14):S290-S304.
48. Weaver FM, Follett K, Stern M, et al. Bilateral deep brain stimulation vs best medical therapy for patients with advanced Parkinson disease: a randomized controlled trial. JAMA. 2009;301:63-73.
49. Toft M, Dietrichs E. Medication costs following subthalamic nucleus deep brain stimulation for Parkinson's disease. Mov Disord. 2014;29:275-276.
50. Odekerken VJ, Boel JA, Schmand BA, et al. GPi vs STN deep brain stimulation for Parkinson disease: three-year follow-up. Neurology. 2016;86:755-761.
51. Boel JA, Odekerken VJ, Geurtsen GJ, et al. Psychiatric and social outcome after deep brain stimulation for advanced Parkinson's disease. Mov Disord. 2016;31:409-413.
52. Bjerknes S, Skogseid IM, S^hle T, Dietrichs E, Toft M. Surgical site infections after deep brain stimulation surgery: frequency, characteristics and management in a 10-year period. PLoS One. 2014;9:e105288.
53. Toft M, Lilleeng B, Ramm-Pettersen J, et al. Long-term efficacy and mortality in Parkinson's disease patients treated with subthalamic stimulation. Mov Disord. 2011;26:1931-1934.
54. Odin P, Ray Chaudhuri K, Slevin JT, et al. Collective physician perspectives on non-oral medication approaches for the management of clinically relevant unresolved issues in Parkinson's disease: consensus from an international survey and discussion program. Parkinsonism Relat Disord. 2015;21:1133-1144.
55. Soulas T, Gurruchaga JM, Palfi S, Cesaro P, Nguyen JP, Fenelon G. Attempted and completed suicides after subthalamic nucleus stimulation for Parkinson's disease. J Neurol Neurosurg Psychiatry. 2008;79:952-954.
56. Weintraub D, Duda JE, Carlson K, et al. Suicide ideation and behaviours after STN and GPi DBS surgery for Parkinson's disease: results from a randomised, controlled trial. J Neurol Neurosurg Psychiatry. 2013;84:1113-1118.
57. Temel Y, Kessels A, Tan S, Topdag A, Boon P, Visser-Vandewalle V. Behavioural changes after bilateral subthalamic stimulation in advanced Parkinson disease: a systematic review. Parkinsonism Relat Disord. 2006;12:265-272.
58. Xie Y, Meng X, Xiao J, Zhang J, Zhang J. Cognitive changes following bilateral deep brain stimulation of subthalamic nucleus in Parkinson's disease: a meta-analysis. Biomed Res Int. 2016;2016:3596415.
59. Pham U, Solbakk AK, Skogseid IM, et al. Personality changes after deep brain stimulation in Parkinson's disease. Parkinsons Dis. 2015;2015:490507.
60. Nyholm D, Nilsson Remahl AI, Dizdar N, et al. Duodenal levodopa infusion monotherapy vs oral polypharmacy in advanced Parkinson disease. Neurology. 2005;64:216-223.
61. Nyholm D, Klangemo K, Johansson A. Levodopa/carbidopa intestinal gel infusion long-term therapy in advanced Parkinson's disease. Eur J Neurol. 2012;19:1079-1085.
62. Olanow CW, Kieburtz K, Odin P, et al. Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson's disease: a randomised, controlled, double-blind, doubledummy study. Lancet Neurol. 2014;13:141-149.
63. Fernandez HH, Standaert DG, Hauser RA, et al. Levodopa-carbidopa intestinal gel in advanced Parkinson's disease: final 12-month, open- label results. Mov Disord. 2015;30:500-509.
64. Buongiorno M, Antonelli F, Camara A, et al. Long-term response to continuous duodenal infusion of levodopa/carbidopa gel in patients with advanced Parkinson disease: the Barcelona registry. Parkinsonism Relat Disord. 2015;21:871-876.
65. Antonini A, Fung VS, Boyd JT, et al. Effect of levodopa-carbidopa intestinal gel on dyskinesia in advanced Parkinson's disease patients. Mov Disord. 2016;31:530-537.
66. Lang AE, Rodriguez RL, Boyd JT, et al. Integrated safety of levodopa- carbidopa intestinal gel from prospective clinical trials. Mov Disord. 2016;31:538-546.
67. Uncini A, Eleopra R, Onofrj M. Polyneuropathy associated with duodenal infusion of levodopa in Parkinson's disease: features, pathogenesis and management. J Neurol Neurosurg Psychiatry. 2015;86:490-495.
68. Antonini A, Isaias IU, Rodolfi G, et al. A 5-year prospective assessment of advanced Parkinson disease patients treated with subcutaneous apomorphine infusion or deep brain stimulation. J Neurol. 2011;258:579-585.
69. Manson AJ, Turner K, Lees AJ. Apomorphine monotherapy in the treatment of refractory motor complications of Parkinson's disease: long-term follow-up study of 64 patients. Mov Disord. 2002;17:1235-1241.
70. Katzenschlager R, Hughes A, Evans A, et al. Continuous subcutaneous apomorphine therapy improves dyskinesias in Parkinson's disease: a prospective study using single-dose challenges. Mov Disord. 2005;20:151-157.
71. Drapier S, Gillioz AS, Leray E, et al. Apomorphine infusion in advanced Parkinson's patients with subthalamic stimulation contraindications. Parkinsonism Relat Disord. 2012;18:40-44.
72. Drapier S, Eusebio A, Degos B, et al. Quality of life in Parkinson's disease improved by apomorphine pump: the OPTIPUMP cohort study. J Neurol. 2016;263:1111-1119.
73. Borgemeester RW, Drent M, van Laar T. Motor and non-motor outcomes of continuous apomorphine infusion in 125 Parkinson's disease patients. Parkinsonism Relat Disord. 2016;23:17-22.
74. Martinez-Martin P, Reddy P, Katzenschlager R, et al. EuroInf: a multicenter comparative observational study of apomorphine and levodopa infusion in Parkinson's disease. Mov Disord. 2015;30:510-516.
75. Volkmann J, Albanese A, Antonini A, et al. Selecting deep brain stimulation or infusion therapies in advanced Parkinson's disease: an evidence-based review. J Neurol. 2013;260:2701-2714.
76. Odin P, Nyholm D. Patient selection for continuous dopaminergic stimulation therapy. In: Aquilonius S-M, Mouradian MM, eds. Parkinson's Disease. Role of Continuous Dopaminergic Stimulation. Crowthorne: ESP Bioscience; 2012:162-172.
Консенсусные критерии диагностики поздней стадии болезни Паркинсона
по материалам: Luquin, Maria-Rosario "Consensus on the Definition of Advanced Parkinson’s Disease: A Neurologists-Based Delphi Study (CEPA Study)."
Parkinson’s Disease 2017 (2017): 4047392. PMC. Web. 4 Mar. 2017.
| Уровень значимости | Общие характеристики | Инвалидизация | Моторные симптомы, связанные с лечением | Моторные симптомы, связанные с заболеванием | Немоторные симптомы, связанные с заболеванием | Нейропсихиатрические и когнитивные нарушения |
|---|---|---|---|---|---|---|
| Определённые признаки | Требуется помощь в повседневной жизни | Моторные флуктуации >25% времени, не ограничивающие основные виды активности пациента, не вызывающие необходимости в посторонней помощи | Тяжёлая дисфагия, повторные падения | Деменция | ||
| Вероятные признаки* | Время течения заболевания (около 10 лет) | Ограничения в повседневной активности, при этом, пациенту не требуется посторонняя помощь | Функционально значимые дискинезии, которые отмечаются у пациента > 25% времени | Умеренная дисфагия, «застывания» при ходьбе, умеренно выраженная дизартрия | Галлюцинации с развитием дезориентированности | |
| Возможные признаки** | Нарушения равновесия и постуральной устойчивости | Клинически значимые вегетативные нарушения, включая ортостатическую гипотензию, повышенную сонливость в дневное время | Умеренно выраженная апатия, постоянные галлюцинации с сохранением ориентированности Психотические нарушения Умеренные когнитивные нарушения |
*Сочетание двух вероятных признаков различных групп (общие характеристики, инвалидизация, моторные симптомы, связанные с лечением и т.д.) делает их определёнными.
**Сочетание одного возможного моторного и немоторного симптома, связанного с заболеванием, с одним возможным нейропсихиатрическим симптомом/когнитивными нарушениями, делает их вероятными.
Симптомы болезни Паркинсона
Моторные (двигательные) симптомы
- Брадикинезия
- Ригидность
- Тремор
- Постуральная неустойчивость
- Нарушения ходьбы
Немоторные симптомы
- Запоры
- Нарушения мочеиспускания (недержание, неудержание мочи, ощущение неполного опорожнения мочевого пузыря)
- Нарушения потенции
- Ортостатическая гипотензия
- Гипотензия после еды
- Апатия
- Депрессия
- Тревога
- Когнитивные нарушения, в том числе деменция
- Психозы (чаще, у пациентов с когнитивными нарушениями, особенно, дементных)
- Расстройства импульсного контроля
- Нарушения сна
- Нарушения любрикации влагалища, боли при половом акте
Клинико-диагностические критерии Банка головного мозга общества БП Великобритании
(Gibb, Lees, 1988; Hughes A. J. et al., 1992).
1. Синдром паркинсонизма:
- наличие гипокинезии (замедленность инициации произвольных движений с прогрессирующим снижением скорости и амплитуды повторных движений);
- наличие по меньшей мере одного из следующих симптомов: мышечная ригидность, тремор покоя 4–6 Гц, постуральная неустойчивость, не связанная со зрительной, вестибулярной, мозжечковой или проприоцептивной дисфункцией.
2. Критерии исключения БП:
- наличие в анамнезе повторных инсультов со ступенеобразным прогрессированием симптомов паркинсонизма;
- повторные черепно-мозговые травмы или достоверный энцефалит;
- окулогирные кризы;
- лечение нейролептиками перед дебютом болезни;
- длительная ремиссия;
- строго односторонние проявления в течение более трех лет;
- супрануклеарный паралич взора;
- мозжечковые знаки;
- раннее появление симптомов выраженной вегетативной недостаточности;
- раннее появление выраженной деменции;
- симптом Бабинского;
- наличие церебральной опухоли или открытой (сообщающейся гидроцефалии);
- негативная реакция на большие дозы левовращающего изомера дезоксифенилаланина (Л-ДОФА) (если исключена мальабсорбция);
- интоксикация МФТП.
3. Критерии, подтверждающие БП (для достоверного диагноза необходимо наличие трех и более симптомов):
- одностороннее начало проявлений болезни;
- наличие тремора покоя;
- постоянная асимметрия с более выраженными симптомами на стороне тела, с которой началась болезнь;
- хорошая реакция (70–100%) на Л-ДОФА;
- прогрессирующее течение заболевания;
- наличие выраженной дискинезии, индуцированной Л-ДОФА;
- откликаемость на Л-ДОФА в течение 5 лет и более;
- длительное течение заболевания (10 лет и более).
Болезнь Паркинсона является основной причиной синдрома паркинсонизма (сочетание гипокинезии, ригидности и тремора). Далее, по убыванию значимости, следуют лекарственный паркинсонизм (чаще у более молодых людей, которые принимают нейролептики) и сосудистый паркинсонизм (пожилые люди, страдающие гипертонией и диабетом, часто, с повторными инсультами в анамнезе).
Распространённость болезни Паркинсона составляет 180-300 на 100 000 населения.
Это одно из наиболее часто встречающихся заболеваний пожилых людей - в возрасте старше 60 лет заболеванием страдает около 1% населения.
Однозначных представлений о причинах болезни Паркинсона в настоящее время нет. У 15-20% пациентов есть родственники, страдающие болезнью Паркинсона. Считается что развитие болезни вызвано сочетанием генетических аномалий, особенностей образа жизни и окружающей среды.
В большинстве случаев начала в возрасте <50 лет, предполагается наследственная природа заболевания. Описано несколько изменений генов, повышающих риск развития болезни Паркинсона. При этом, выявление характерного для болезни генетического изменения, не означает 100% риска развития заболевания в будущем.
Эффективных мер профилактики в настоящее время нет. Ни один из современных лекарственных препаратов не может замедлить процессы, приводящие к болезни. Однако, несмотря на неудачи, поиски в этой области не прекращаются.
Нет и инструмента, позволяющего предсказать скорость прогрессирования болезни. Относительная выраженность симптомов заболевания на разных стадия может меняться: например, в начале - преобладает тремор, а затем, он исчезает и основной проблемой является замедленность движения.
Основные признаки болезни включают двигательные нарушения: замедленность движений, общая скованность/повышение тонуса мышц и дрожание. Последний симптом пациенты чаще всего замечают у себя сами.
Симптомы часто появляются с одной стороны и некоторое время, их выраженность справа и слева отличаются, в дальнейшем, различия между сторонами исчезают.
На более поздних стадиях у пациентов развиваются нарушения ходьбы и устойчивости.
Иногда, болезнь начинается с симптомов, не связанных с движениями: запоры, нарушения сна и поведения во сне (резкие движения, крики), депрессия. Двигательные симптомы обязательно развиваются, но позднее.
В исследованиях показана более высокая распространённость нарушений обоняния (гипосмии) у пациентов, которым впервые устанавливается диагноз "болезнь Паркинсона". Гипосмия может возникать за несколько лет до развития двигательных симптомов.
Развитие нарушений памяти, поведения, резких эпизодов падения артериального давления после перехода в вертикальное положение в начале заболевания не характерно для болезни.
Набор жалоб и последовательность их развития являются достаточным основанием для постановки диагноза. Долгое время врачами использовались диагностические критерии Банка головного мозга общества болезни Паркинсона Великобритании (Gibb, Lees, 1988, 2009). На смену им пришли Диагностические критерии болезни Паркинсона Международного общества изучения двигательных расстройств (2015), основанные на Унифицированной шкале оценки болезни болезни Паркинсона Международного общества расстройств движений (MDS UPDRS).
Специфических изменений, выявляемых помощи МРТ головного мозга и других методов визуализации (например, УЗИ головного мозга) у больных болезнью Паркинсона не установлено, также в настоящее время не разработано специальных лабораторных методов, позволяющих установить диагноз со 100% точностью.
Проведение сцинтиграфии с оценкой транспорта дофамина в полосатом теле (DaTscan), с высокой точностью выделяющее пациентов с нейродегенеративным паркинсонизмом, требуется лишь небольшому количеству пациентов, клинический диагноз у которых вызывает затруднения.
Благодаря современным противопаркинсоническим препаратам, ожидаемая продолжительность жизни пациентов с БП не меньше, чем у их здоровых сверстников.
На начальных стадиях, лечение контролирует моторные симптомы: устраняет или резко уменьшает скованность и замедленность, оказывает умеренный эффект на дрожание и неустойчивость. Качество жизни пациента может нарушаться из-за немоторных симптомов: депрессии, нарушений сна, запоров, нарушений потенции. Лечение этих расстройств не столь эффективно.
В дальнейшем, двигательные симптомы прогрессируют, а возможности лечения ограничиваются осложнениями терапии и усилением флуктуаций (колебания эффективности препарата — выраженности двигательных нарушений, феномен «включения-выключения», феномен «невключения», непроизвольные движения, связанные с уровнем препарата в крови — дискинезии), осложнения лекарственной терапии через 5 лет после начала заболевания развиваются приблизительно у половины пациентов, а через 10 лет - доля таких пациентов достигает 80%. Вероятность осложнений зависит от правильности выбора групп и доз препаратов на каждой стадии болезни.
Пациенты страдают от симптомов, плохо поддающихся лекарственной коррекции — замедленности ходьбы, неустойчивости, а также симптомов, не связанных с движениями, прежде всего апатии и депрессии, в меньшей степени - нарушений памяти и мышления.
У существенной части пациентов интеллект не страдает даже на поздних стадиях болезни с грубыми двигательными симптомами. При этом, у пациентов часто есть характерные личностные черты: «застреваемость» внимания, педантизм, тревожность. Они испытывают страх перед сменой обстановки, изменением схемы лечения, что часто является причиной жалоб и ухудшения самочувствия при радикальной коррекции терапии.
Темп прогрессирования заболевания индивидуален.
Довольно часто, смерть наступает от причин, общих для всех пожилых людей, не связанных с БП, например, онкологического заболевания, инфаркта или инсульта.
Для лечения болезни Паркинсона используется несколько групп препаратов, позволяющих компенсировать дефицит нейромедиатора дофамина, лежащий в основе развития двигательных симптомов заболевания.
Наиболее эффективными являются препараты леводопы - предшественника дофамина. Карбидопа и бенсеразид - обязательные составляющие современных препаратов леводопы - защищают действующее вещество от разрушения в желудочно-кишечном тракте.
Недостатком препаратов леводопы является развитие на фоне лечения лекарственных осложнений - прежде всего, непроизвольных движений - "дискинезий". Вероятность развития дискинезий усиливается с увеличением продолжительности лечения и дозы препаратов, ввиду чего, пациенты получают лекарство в минимальной необходимой дозе.
Чтобы уменьшить потребность в препаратах леводопы и/или отсрочить необходимость их назначения, используются препараты других групп: агонисты дофамина, амантадины, антихолинергические препараты. Общепризнанной последовательности назначения лекарств не существует. Есть доводы как в пользу более позднего, так и более раннего назначения препаратов леводопы.
Более подробно о лечении в моей статье о болезни Паркинсона на Общества доказательной неврологии.
Наряду с дискинезиями, противопаркинсонические лекарства могут вызывать другие нарушения. К ним относятся снижение артериального давления при вставании (ортостатическая гипотензия) или после приёма пищи (постпрандиальная гипотензия), головокружение, нестабильность настроения, нарушения памяти и внимания. Их набор сходен с набором симптомов поздней стадии болезни Паркинсона, поэтому, утверждать, что лекарства сами по себе виновны в недомогании, сложно.
Приём препаратов леводопы нередко сопровождается тошнотой. Для устранения тошноты допускается приём препарата вместе с пищей, содержащей небольшое количество белка (овсяная каша на воде, кусочек яблока). В более тяжёлых случаях, пациентам назначаются противорвотные препараты (но, не нейролептики) или средства, улучшающие моторику желудочно-кишечного тракта (домперидон).
Принимать решение о коррекции дозы или назначении дополнительных препаратов, чтобы уменьшить симптомы осложнений лечения, может только опытный врач. Порой, жалобы пациента не связаны ни болезнью Паркинсона, ни с её лечением.
Оперативное лечение показано только пациентам с осложнениями терапии леводопой — дискинезиями, если они не корректируются лекарственными препаратами. Реже, операция проводится для уменьшения дрожания. Вмешательство позволяет продолжить принимать препараты леводопы в дозах, достаточных для того, чтобы уменьшить скованность и замедленность движений.
Несмотря на большую техническую сложность и дороговизну, глубокая стимуляция головного мозга является более предпочительным методом, чем разрушающие операции (поствентральная паллидотомия).
Страница 1 из 2